高一化学必修1第三章《金属及其化合物》测试题(B卷)
相对原子量:H 1 O 16 Na 23 Mg 24 Al 27 Fe 56 Zn 65
一、选择题(每小题只有一个正确答案,每小题4分,共56分。)
1、下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是
① NaHCO3 ② Al2O3 ③ Al(OH)3 ④ Al
A.①②③④ B.①和③ C.③和④ D.①和④
2、鉴别固体Na2CO3和NaHCO3,下列方法可行的是
A.分别配成溶液,再加入澄清石灰水
B.分别配成溶液,再加入氢氧化钠溶液
C.分别加热,再检验是否有使澄清石灰水变浑浊的气体产生
D.分别配成溶液,再进行焰色反应
3、钠与水反应时的现象与钠的下列性质无关的是
A. 钠的熔点低 B. 钠的密度小
C. 钠的硬度小 D. 钠有强的还原性
4、要证明某溶液中不含Fe3+而可能含有Fe2+。进行如下实验操作时最佳顺序为 ①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A. ③① B. ③② C. ①③ D. ①②③
5、地壳中含量最多的金属元素和含量最多的非金属元素形成的化合物,其式量为
A. 40 B. 56 C. 102 D. 160
6、钠长期放置在空气中,最后变为
A. Na2O B. Na2O2 C. NaOH D. Na2CO3
7、两份铝屑,第一份与足量盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1:2,则第一份与第二份铝屑的质量比为
A. 1:1 B. 1:2 C. 1:3 D. 2:1
8、只用一种试剂即可区别的:NaCl、MgCl2、FeCl3、Al2(SO4)3四种溶液,这种试剂是
A. AgNO3 B. NaOH C. BaCl2 D.HCl
9、下列各组离子能在pH=1的无色溶液中大量共存的是
A. K+、Cl-、HCO3-、SO42- B. Mg2+、Cl-、Al3+、SO42-
C. Ca2+、Fe3+、Na+、NO3- D. Ba2+、Cl-、Na+、CO32-
10、下列对合金的说法正确的是
A. 合金中至少含有两种金属元素 B.合金中的金属元素以化合物的形式存在
C. 黄铜是纯净物 D. 合金中也可含非金属元素
11、下列关于Na2O和Na2O2的叙述正确的是
A.都是白色固体 B.都是碱性氧化物
C.都能和水反应形成强碱溶液 D.都是强氧化剂
12、地壳中铜元素的含量远比铁元素少,但历史上金属铜的使用比铁要早得多,如铜钱曾经是历史上广泛使用的货币,用铜而不用铁铸钱币的理由是:① 铜的化学性质比较稳定,不易腐蚀。② 铜的熔点较低,易冶炼 ③ 铜的硬度较小,易加工
A.①② B.②③ C.①③ D.①②③
13、某化合物的溶液中可能含有下列离子,当加入NaOH溶液时,有沉淀生成;另取该化合物的溶液,并加入铁粉,溶液的质量将增加,该溶液中一定含有
A.Cu2+ B.Fe3+ C.Al3+ D.Mg2+
14、制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2 。向盛氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁铜都有 D.烧杯中铁铜都无
二、非选择题(44分)
15、(6分)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质,请你设计1个检验硫酸亚铁是否变质的实验方案:
。
如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质?
。
16、(13分)FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量 铁粉 | ||
| ② | 加入少量Na2O2粉末 | ||
| ③ | 加入少量AgNO3溶液 |
17、(10分)某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色
 |
写出下列物质的化学式:
A: B:
C: D:
X:
18. (8分)写出化学方程式,一步实现下列转变。
(1) Al→NaOH
(2) Al2O3→AlCl3
(3) Fe(OH)2→Fe(OH)3
(4) Na2O2→Na2CO3
19.(8分)向20mLAlCl3溶液中滴入2mol·L-1NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
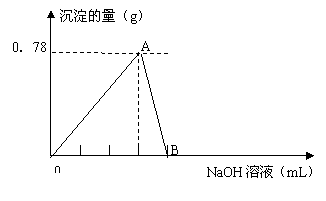 |
(1) A点表示的意义是
(2) B点表示的意义是
(3) 假设溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为
(写出计算过程)
高一化学必修1第三章(B卷)测试题参考答案
1.A 2.C 3.C 4.A 5.C 6.D 7.B 8.B 9.B 10.D 11.C 12.A 13.B 14.B
15.取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质(4分)。配制硫酸亚铁溶液时,在溶液中加入少量还原铁粉(2分)
16.(每个实验现象1分,共5分。离子方程式每式2分,共8分。)
| 编号 | 实验操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量铁粉 | 铁粉部分溶解,溶液有棕黄色变浅绿色(2分) | 2Fe3++Fe=3Fe2+ |
| ② | 加入少量Na2O2粉末 | 生成红褐色沉淀并放出无色无味气体(2分) | 2Na2O2+2H2O=4Na++4OH-+O2↑ Fe3++3OH-=Fe(OH)3↓ |
| ③ | 加入少量AgNO3溶液 | 生成白色沉淀(1分) | Ag++Cl-=AgCl↓ |
17.(每个2分)A:Fe(OH)3 B:Fe2O3 D: FeCl3 E:FeCl2 X: Fe
18. (每式2分,共8分)
(1)Al→NaOH 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2)Al2O3→AlCl3 Al2O3+6HCl=2AlCl3+3H2O
(3)Fe(OH)2→Fe(OH)3 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(4)Na2O2→Na2CO3 2Na2O2+2CO2=2Na2CO3+O2
19.(1)表示滴入NaOH溶液产生沉淀量最大点 (1分)
(2)表示滴入NaOH溶液沉淀恰好完全溶解点(1分)
(3)7.5mL或17.5mL (要写出规范的计算过程) (6分)