高一化学上学期期末考试试题
高 一 化 学
命题人:倪祖华 审题人:陈水金
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
第Ⅰ卷1至2页,第Ⅱ卷3至6页。满分100分,考试时间90分钟。
注意事项:
1.答题前,请考生将自己的学校、姓名、考号、班级填写在试卷指定位置。
2.第Ⅰ卷答案写在第Ⅱ卷卷首答题栏内,第Ⅱ卷答案写在各题指定答题处。
3.化学计算中可能用到的相对原子质量:
H-1;C-12;O-16;Li-7;Na-23;K-39;Cl-35.5 ;Rb-86;Ca-40;N-14
第Ⅰ卷(选择题,共42分)
选择题(共14小题,每小题3分,共42分。每小题只有一项符合题目要求。)
1.目前世界各国都面临能源问题,现在人类直接利用的主要能源是
A.太阳能 B.核能 C.氢能 D.化石燃料
2.同温同压下,两种气体的体积如果不相同,其主要原因是
A.气体的分子大小不同 B.气体分子间的平均距离不同
C.气体的物质的量不同 D.气体的性质不同
3.下列性质中按Li、Na、K、Rb、Cs的顺序依次减弱(或减小)的是
A.电子层数 B.单质的还原 C.金属性 D.熔点和沸点
4.欲除去小苏打溶液中少量的苏打杂质,加入的物质最宜选用
A.干冰 B.盐酸 C.碳酸氢钙 D.氢氧化钙
5.已知在相同条件下,气体物质的量与气体的压强成正比。同温同体积同质量的CO2、CO、H2、O2的压强,按从大到小的顺序排列正确的是
A.H2>O2>CO>CO2 B.H2>CO>O2>CO2
C.CO2>O2>CO>H2 D.CO2>H2>O2>CO
6.设NA为阿伏加德罗常数,下列说法中不正确的是
A.2.3g金属钠变为钠离子时失去的电子数是0.1NA
B.28g氮气所含原子数为2NA
C.5NA个氯分子所占体积约为11.2L
D.18g水所含的质子总数为10NA
7.下列离子方程式中,不正确的是
A.亚硫酸钡与盐酸反应:BaSO3+2H+=Ba2++SO2↑+H2O
B.二氧化碳通入足量的氢氧化钠溶液:CO2+OH-=HCO3-
C.三氧化二铁溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O
D.碳酸钠溶液与过量稀盐酸反应:CO32-+2H+=CO2↑+H2O
8.能用H++OH-=H2O表示的化学方程式有
(1)氢氧化钠溶液与盐酸反应 (2)氢氧化铁与硫酸反应
(3)氢氧化钡与硫酸反应 (4)硫酸氢钠与氢氧化钠溶液反应
A.(1)(2) B.(3)(4) C.(1)(3) D.(1)(4)
9.大多数金属在加热或灼烧的条件下,都能与氯气发生反应生成氯化物。下图所示装置可用作金属钠与氯气反应实验。玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,当钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是

A.反应生成的白烟是NaCl晶体
B.钠着火燃烧产生苍白色火焰
C.浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.若在棉球外沿滴一滴淀粉碘化钾溶液,可判断氯气是否被碱液完全吸收
10.把7.4gNa2CO310H2O和NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留固体的质量是
A.3.18g B.2.12g C.4.22g D.5.28g
11.氧化还原反应的实质是
A.反应中原子重新组合 B.得氧、失氧
C.化合价升降 D.电子转移
12.溴(Br)与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性更强,下面是根据氯的性质对溴的性质的预测,其中错误的是
A.溴单质溶于水时,部分与H2O反应生成HBrO和HBr
B.溴单质只具有氧化性
C.溴原子最外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴蒸气与氢气在加热下反应生成HBr
13.将15g下列各组内两种金属的混合物投入水中,若收集到0.5g氢气,此种混合物不可能是
A.Li和Na B.Rb和Ca C.Na和Cu D.K和Na
14.将质量分数为a%的NaOH溶液蒸发掉m g水后,变成V mL 3a%的NaOH溶液(蒸发过程中无晶体析出)则蒸发后所得溶液的物质的量浓度是 (mol/L)
A. B. C. D.
鄂州市2007—2008学年度上学期期末考试
高 一 化 学 答 题 卷
第І卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 |
评 分 栏
| 题号 | 1~14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 总分 |
| 得分 |
第Ⅱ卷(非选择题,共58分)
15.(共6分)
![]()
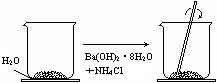 在一小烧杯中,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上。然后再加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。
在一小烧杯中,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上。然后再加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。
(1)玻璃棒的作用是 。
 |
(2)该实验中观察到的现象是 ,说明该反应为___________热反应,该反应的能量变化情况,可以用下图中的_________(填“A”或“B”)表示。
(3)猜测产生(2)中现象可能的原因(至少两条):
;
。
16.(共14分)
用如下图所示的装置,设计用Cl2气与Cu反应制取CuCl2的实验。
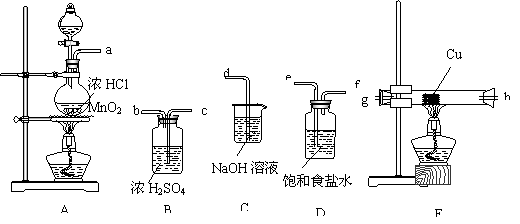 |
(1)若气流方向从左至右,上述装置的连接顺序为 。(填接口编号)。
(2)写出A中发生反应的离子方程式 。
(3)浓H2SO4的作用是 ;饱和食盐水的作用是 ;NaOH溶液的作用是 。
(4)E装置产生的反应现象是 。
(5)实验结束时,应先熄灭__________处酒精灯。
17.(共6分)
现用18.4mol/L的浓H2SO4来配制500mL0.2mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有 (填代号),还缺少的仪器是 。
(2)经计算,需浓H2SO4的体积为 mL ,量取浓硫酸时应选用 mL的量筒 (选填①10mL、②50mL、③100mL三种规格)。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2mol/L。请你分析配制过程中可能引起测定浓度值增大的原因(写出其中一个即可)。
答: 。
18.(共8分)
有Zn、Cl2、NaOH溶液、KBr溶液、FeCl2溶液五种物质,按下列要求,选用其中的两种物质,并写出相应的离子方程式。
(1)一种单质氧化一种阳离子:
;
(2)一种单质还原一种阳离子:
;
(3)一种单质氧化一种阴离子:
;
(4)一种单质在同一反应中既是氧化剂又是还原剂:
。
19.(共10分)
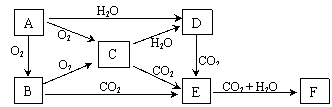 |
已知物质A、B、C、D、E、F在一定条件下的关系如图所示,该六种物质的焰色反应均呈黄色。
(1)写出下列物质的化学式:A___________、D___________、F___________;
(2)A、B、C、D四种物质分别长期暴露在空气中,其最终产物为_____________,其中变质过程中有氧化还原反应发生的物质是(填写物质对应的化学式):
;
(3)将C加入CuSO4溶液中,发生的反应的方程式为:
;
(4)A在CO2中燃烧有黑色固体物质生成,其化学方程式为:
。
20.(共10分)
一块表面已部分氧化(氧化层为Na2O)的金属钠样品质量为0.77g,放入100m水中后,得到标准状况下氢气的体积224 mL。求:
(1)该金属钠样品中含金属钠多少克?
(2)所得溶液溶质的物质的量浓度约为多少(设最终所得溶液的体积仍为100mL)?
鄂高一化学上学期期末考试试题
高一化学参考答案及评分标准
(选择题1~14题每题3分,共42分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | D | C | D | A | B | C | B | D | B | A | D | B | A | D |
15.(共10分)
①搅拌,使反应物混合均匀,反应充分 (2分)
②玻璃片上的水结冰而将玻璃片与小烧杯粘在一起 (2分)
吸(2分),B(2分)
③氢氧化钡晶体[Ba(OH)2·8H2O]脱水为吸热;
复分解反应吸热;
NH4Cl晶体溶于水为吸热。(2分)
16.(共14分)
(1)a e f c b g h d (2分)
(2)MnO2+4H++2Cl-==Mn2++Cl2↑+2H2O (2分)
(3)干燥Cl2气或除去Cl2气中的水蒸气(2分)
除去Cl2气中的HCl(2分)
吸收多余的Cl2气,防止污染环境(2分)
(4)产生棕色的烟(2分)
(5)E(2分)
17.(共6分)
(1)②⑥⑦ (1分) 500 mL 的容量瓶。(1分)
(2)5.4 mL (1分) 10 mL (1分)
(3)定容时,俯视标线
(或“洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中”、“量浓H2SO4仰视刻度线时”等其他合理答案)。(2分)
18.(共8分)
(1)Cl2+2Fe2+=2F3++2Cl- (2分)
(2)Zn+2H+=Zn2++H2↑(2分)
(3)Cl2+2Br-=Br2+2Cl-(2分)
![]() (4)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(4)Cl2+2OH-=Cl-+ClO-+H2O(2分)
19.(共10分)
(1)Na(1分);NaOH(1分);NaHCO3(1分)
(2)Na2CO3(1分); Na2O2、Na (2分)
(3)2Na2O2+2H2O+2CuSO4==2Cu(OH)2↓+2Na2SO4+O2↑(2分)(用分步反应表示亦可)
(4)2Na+CO2==C+Na2O2 或4Na+3CO2==C+2Na2CO3(2分)
20.(共10分)
2Na + 2H2O == 2 NaOH + H2↑、Na2O + H2O == 2NaOH(2分)
(1)2Na + 2H2O == 2 NaOH + H2↑
2 mol 22400 mL
(0.02 mol) 224 mL
m(Na)= 0.02 mol×23 g / mol =0.46 g (4分)
(2) m(Na2O)= 0.77 g - 0.46 g = 0.31 g
n(Na2O)= 0.31 g ÷62 g / mol = 0.005 mol
![]() n(NaOH)= n(Na)
+ 2 n(Na2O)= 0.02
mol+2×0.005 mol = 0.03 mol
n(NaOH)= n(Na)
+ 2 n(Na2O)= 0.02
mol+2×0.005 mol = 0.03 mol
![]() (4分)
(4分)