05---06学年下学期
高一化学必修2模块终结性评价题
试卷说明:本卷考试用时90分钟。总分150分,第Ⅰ卷共80分,第Ⅱ卷共70分。第Ⅰ卷的答案请涂在答题卡上,第Ⅱ卷的答案请填写在答题卷上。
相对原子质量: C:12 H :1 O:16
第Ⅰ卷(共80分)
一、选择题(每题只有一个答案符合题意 共10×4=40分)
1、大量获得乙烯的工业方法是
A.煤的干馏 B.石油分馏 C.石油裂化 D.石油裂解
2、当前我国环保急待解决的“白色污染”通常指的是
A.金属冶炼厂的白色烟尘 B.石灰窑的白色粉尘
C.聚乙烯等塑料垃圾 D.白色建筑废料
3、下列物质不能使酸性高锰酸钾溶液褪色的是
A.SO2 B.苯 C.乙烯 D.乙醇
4、下列各组液体混合物,能用分液漏斗分离的是
A.乙酸和水 B.液溴和苯 C.苯和水 D.乙醇和水
5、下列叙述正确的是
A.淀粉与纤维素是互为同分异构体 B.乙烯可作果实的催熟剂
C.油脂不是酯 D.充分燃烧后产生二氧化碳和水的有机物就是烃
6、氟里昂(CCl2F2 :二氟二氯甲烷)是常用的制冷剂,但近年的研究表明,它会破坏臭气层。现科学家研究出它的一种替代品:CH2F2(二氟甲烷),关于二氟甲烷的叙述不正确的是
A.它可能是甲烷与氟气发生取代的产物 B.它有两种同分异构体
C.它属于烃的衍生物 D.它不存在同分异构现象
7、 己烯是乙烯的同系物,常温下是无色的液体,难溶于水,比水轻。鉴别己烯、乙酸、苯四种无色溶液或液体,可用的一种试剂是
A.盐酸 B.食盐 C.新制的氢氧化铜 D.溴水
8、青苹果(末成熟的苹果)汁遇碘变蓝色,熟的苹果汁能发生银镜反应,这说明
A、青苹果中只含淀粉,不含糖类物质 B、熟的苹果中只含糖类,不含淀粉
C、苹果从青转熟时,淀粉水解生成单糖 D、苹果从青转熟时,单糖缩聚成淀粉
9.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是
A. S B. C C.Si D. Cl
10、在2L密闭容器中,在一定条件下发生A+3B![]() 2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则ν(C)为
2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则ν(C)为
A.0.04mol/(L.s) B.0.08mol/(L.s) C.0.4mol/(L.s) D.0.8mol/(L.s)
二、选择题(每题有1~2个选项符合题意,共10×4= 40分)
11、下列试剂中,能用于检验酒精中是否含水的最简单的试剂是
A.新制生石灰 B.无水硫酸铜 C.浓硫酸 D.金属钠
12、下列各组物质中,互为同系物的是
A.葡萄糖与蔗糖 B.CH2=CH-CH3和CH2=CH-CH2-CH3
C.甲烷与丙烷 D.丁烷与异丁烷
13、为了鉴别某白色纺织品的成分是真蚕丝(蛋白质)还是“人造丝”(合成纤维),可选用的方法是
A.滴加浓硝酸 B.滴加浓硫酸 C.滴加酒精 D.灼烧
14、下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2S B.BF3 C.CI4 D.PCl5
15、可逆反应:2NO2(g) ![]() 2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
① 单位时间内生成nmol O2的同时生成2nmol NO2
② 单位时间内生成nmol O2的同时生成2nmol NO
③ 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
A.①④ B.②③⑤ C.①③④ D.①②③④⑤
16、下列说法中错误的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
17、下列递变规律正确的是
A.HClO4、H2SO4、H3PO4的酸性依次增强,
B.HCl、HBr 、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.P、S、Cl最高正价依次降低。
18、石墨与金刚石都是碳的单质,工业上常用石墨在一定条件下转化为金刚石的反应原理生产人造钻石。已知12g石墨完全转化成金刚石时需要吸收E kJ的能量。则下列说法正确的是
A.石墨不如金刚石稳定 B.金刚石不如石墨稳定
C.等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
D.等质量的石墨和金刚石完全燃烧,石墨放出的能量多
19、废旧电池集中处理的首要原因是
A.回收电池中的石墨电极
B.回收电池外壳的金属材料
C.防止电池中汞、镉等重金属对土壤和水源的污染
D.防止电池中的渗出液腐蚀其他物品
20.NO和CO都是汽车尾气里的有害物质,它们能缓慢反应,生成氮气和二氧化碳。对此反应,下列叙述正确的是
A.使用催化剂不改变反应速率 B.改变温度对反应速率无影响
C.升高温度能加快反应速率 D.使用催化剂一定加快反应速率
第Ⅱ卷(共70分)
三、填空题(共39分)
21.(15分)海洋面积占地球总面积的 。海洋中含有丰富的资源,海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
(1)写出镁元素在周期表中的位置:
(2)氯化钠的电子式 ,用电子式表示水的形成过程
(3)写出重水中的氢元素的核素符号:
22、(12分)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示) ,该反应类型是 ,该反应的原子利用率为 ,决定氯乙烷能用于冷冻麻醉应急处理的具体性质是
23、(6分)“可燃冰”是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。据测定每0.1m3固体“可燃冰”要释放20m3的甲烷气体,“可燃冰”将成为人类的后续能源。“可燃冰”(用甲烷表示)燃烧的化学反应方程式为: ,若把该反应在一定条件下改装成原电池,则在原电池的负极发生反应的物质是: 。
24、(6分)陈先生有一套珍贵的铜制餐具,使用一段时间后餐具会变黑,陈先生会把餐具加热后用无水酒精浸泡,之后餐具便会光洁如新。请写出以上过程的所有化学方程式
四、实验题(20分)
24、(6分)下面实验操作可以实现实验目的的是(填序号)
A、 用铝块与氧化铁粉末充分混和进行铝热反应。
B、 取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖。
C、 用稀硝酸清洗做过银镜反应实验的试管。
D、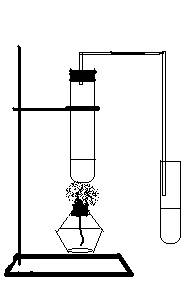 在苯中加入溴水,充分振荡静置,观察现象,判断苯环中的碳碳键是否存在碳碳双键。
在苯中加入溴水,充分振荡静置,观察现象,判断苯环中的碳碳键是否存在碳碳双键。
25(14分)实验室用右图所示的装置制取乙酸乙酯。
(1)写出制取乙酸乙酯的化学方程式:
(2)装置中通蒸气的导管要插到饱和碳酸钠溶液液面上,而不能插入液面以下,目的是防止_________事故的发生。 收集了乙酸乙酯的试管振荡时有气泡产生,请解析产生气泡的原因(用化学方程式表示) 。
(3)实验制取的乙酸乙酯,可用 方法分离乙酸乙酯与饱和的碳酸钠溶液,请用用文字说明使用这种方法的理由: 。
五、计算题(11分)
26.0.1mol某液态烷烃完全燃烧需要消耗0.8mol氧气,通过计算求该烷烃的化学式。写出一种符合该化学式的烃的结构简式。
高一化学必修2模块终结性评价题答案
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | B | C | B | B | D | C | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | BC | AD | C | A | AD | C | BC | C | CD |
三、填空题(共39分)
21.(15分) 71% 。
(1) 第三周期 ⅡA 族
(2) ,
(3) 12H
22、(12分) CH2=CH2+HCl→CH3CH2Cl , 加成反应 , 100% ,
氯乙烷的沸点低,易挥发,挥发时吸收热量起到降温的作用。
![]() 23、(6分) CH4+ 2O2 → CO2+2 H2O , CH4 (写名称也可) 。
23、(6分) CH4+ 2O2 → CO2+2 H2O , CH4 (写名称也可) 。
24、(6分)2Cu+ O2 = 2CuO CuO+ CH3CH2OH →Cu+ CH3CHO+H 2O
四、实验题(20分)
24、(6分)C、D
![]() 25(14分)
25(14分)
(1)CH3CH2OH
+ CH3COOH ![]() CH3COO CH2CH3+H 2O
CH3COO CH2CH3+H 2O
(2)倒吸__。 2CH3COOH+ Na2CO3 = CH3COO Na+H 2O + CO2↑ 。
(3)分液,因为乙酸乙酯常温下液态物质,且与饱和的碳酸钠溶液互不相溶。
五、计算题(11分)
26.
2CnH2n+2+ (3n+1)O2→nC O2+(n+1) H 2O
2 3n+1
0.1mol 0.8mol 2×0.8mol= (3n+1) ×0.1mol n=5
CH3CH2 CH2 CH2 CH3
高一化学必修2模块终结性评价题
答题卷
三、填空题(共39分)
21.(15分) 。
(1)
(2) ,
(3)
22、(12分)
, , 。
。
23、(6分) , 。
24、(6分) , 。
四、实验题(20分)
24、(6分)
25(14分)
(1)
(2) 。
(3) ,
。
五、计算题(11分)
26.