新课标高一化学同步测试(B)
第四节 硫酸、硝酸和氨
一、选择题:(本小题共17小题,每小题5分,共85分)
1.将下列溶液置于敞口容器中,溶液质量会增加的是( )
A.浓硫酸 B.稀硫酸 C.浓盐酸 D.浓硝酸
2.下列变化中,能证明硫酸是强酸的事实是( )
A.能使石蕊试液变红
B.能跟磷酸钙反应制磷酸
C.能跟氯化钠反应制氯化氢
D.能跟锌反应产生氢气
3.![]() g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成![]() L气体,则被还原的H2SO4的量是( )
L气体,则被还原的H2SO4的量是( )
A.![]() mol B.
mol B.![]() mol C.
mol C.![]() g D.
g D.![]() g
g
4.将90%H2SO4溶液和10%H2SO4溶液等体积混合,所得溶液的百分比浓度为( )
A.小于50% B.大于50% C.等于50% D.不能确定
5.下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A.SO2、O2、N2 B.HCl、Cl2、CO2
C.CH4、H2、CO D.SO2、Cl2、O2
6.检验氨气可选用( )
A.湿润的蓝色石蕊试纸 B.干燥的红色石蕊试纸
C.干燥的蓝色石蕊试纸 D.湿润的红色石蕊试纸
7.用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按标准状况下计算)( )
A.0.045mol·L-1 B.1mol·L-1
C.0.029mol·L-1 D.不能确定
8.在标准状况下,1L水中溶解700LNH3,所得溶液的密度为0.9g·cm-3,则氨水的浓度为( )
A.18.4mol·L-1 B.20.4mol·L-1
C.37.7% D.38.5%
9.在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是( )
A.1∶0.45 B.1∶1 C.1∶0.29 D.4.5∶2.9
10.把![]() L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用![]() mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗![]() molBaCl2,则原溶液中
molBaCl2,则原溶液中![]() (NO
(NO![]() )为( )
)为( )
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·1-1
mol·1-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
11.将20mLNO2和NH3的混合气体,在一定条件下充分反应,化学方程式是:6NO2+8NH3![]() 7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是( )
7N2+12H2O。已知参加反应的NO2比NH3少2mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是( )
A.3∶2 B.2∶3 C.3∶7 D.3∶4
12.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
A.H2S+2HNO3![]() S↓+2NO2↑十2H2O
S↓+2NO2↑十2H2O
B.CuO+2HNO3![]() Cu(NO3)2十H2O
Cu(NO3)2十H2O
C.4HNO3![]() 4NO2↑十O2↑十2H2O
4NO2↑十O2↑十2H2O
D.3Cu+8HNO3![]() 3Cu(NO3)2+2NO↑十4H2O
3Cu(NO3)2+2NO↑十4H2O
13.关于硝酸的说法正确的是( )
A.硝酸与金属反应时,主要是+5价的氮得电子
B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水
C.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
14.铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A.Fe2(SO4)3 B.Na2CO3
C.KNO3 D.FeSO4
15.将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.1mol B.0.05mol C.1.05mol D.0.11mol
16.从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
A.铜和浓硝酸反应 B.铜和稀硝酸反应
C.氧化铜和硝酸反应 D.氯化铜和硝酸银反应
17.向50mL18mol·L-1的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是( )
A.等于0.9mol B.大于0.45mol,小于0.9mol
C.等于0.45mol D.小于0.45mol
二、实验题(15分)
18.(1)浓硫酸与木炭粉在加热条件下的化学方程式为_________________________。
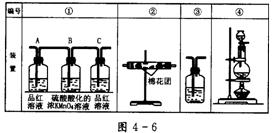
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
__________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______________________,B瓶溶液的作用是____________________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______,确定装置②在整套装置中位置的理由是_____________________。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
答案及详解:
1.A
2.B解析:A、D两项证明硫酸具有酸性;C项证明硫酸具有难挥发性。
3.BC解析:Cu+2H2SO4(浓)![]() CuSO4+SO2↑十2H2O
CuSO4+SO2↑十2H2O
![]() mol
mol ![]() mol
mol
参加反应的Cu,生成的SO2与被还原的H2SO4的物质的量相等。
4.B解析:设各取体积为![]() L,90%H2SO4密度为
L,90%H2SO4密度为![]() ,10%H2SO4密度为
,10%H2SO4密度为![]() ,则
,则![]() >
>![]() 。依题意,混合后溶液的百分比浓度
。依题意,混合后溶液的百分比浓度![]() %=
%=![]() =
=![]() %=
%=![]()
所以![]() %>50%,选B。
%>50%,选B。
5.C解析:A组中SO2不能用碱石灰干燥。B组均不能用碱石灰干燥的气体。D组均可用浓H2SO4作干燥剂,但其中SO2、Cl2不能用碱石灰干燥。
6.D
7.A解析:氨气溶于水形成氨水,其溶质为氨气。设烧瓶的容积为![]() L,则形成溶液的体积为
L,则形成溶液的体积为![]() L,溶质的物质的量为
L,溶质的物质的量为![]() mol,故所得溶液的物质的量浓度为
mol,故所得溶液的物质的量浓度为![]() =0.045mol·L-1
=0.045mol·L-1
8.A解析:氨水的浓度为 mol·L-1
mol·L-1
9.B解析:水充满烧瓶,则所得溶液的体积相同且都等于烧瓶的容积。又因为NH3和HCl的体积相同,物质的量也相同,故溶液的物质的量浓度之比为1∶l。
10.B解析:依题意,NH![]() ~OH-~NH3↑SO
~OH-~NH3↑SO![]() ~Ba2+~BaSO4↓
~Ba2+~BaSO4↓
![]() mol
mol ![]() mol
mol ![]() mol
mol ![]() mol
mol
即混合溶液中含(NH4)2SO4为2![]() mol,其电离产生NH
mol,其电离产生NH![]() 4
4![]() mol,则原混合溶液中NH4NO3的物质的量为(2
mol,则原混合溶液中NH4NO3的物质的量为(2![]() -4
-4![]() )mol,所以,
)mol,所以,![]() (NO
(NO![]() )=
)=![]() mol·L-1,答案选B。
mol·L-1,答案选B。
11.AC 解析:设两气体恰好完全反应,则由反应方程式:
6NO2+8NH3![]() 7N2+12H2O
7N2+12H2O
6 8
![]()
![]()
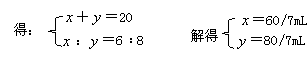
![]() -
-![]() ≠2,故不可能是此种情况。
≠2,故不可能是此种情况。
①若NO2过量,NH3完全反应,设![]() =
=![]() mL,则反应的NO2体积为(
mL,则反应的NO2体积为(![]() -2)mL,应有(
-2)mL,应有(![]() -2)∶=6∶8,解得
-2)∶=6∶8,解得![]() =8mL,故
=8mL,故![]() (NO2):
(NO2):![]() (NH3)=12:8=3:2。
(NH3)=12:8=3:2。
②若NH3过量,NO2完全反应,设![]() (NO2)=
(NO2)=![]() mL,则反应的NH3为(
mL,则反应的NH3为(![]() +2)mL,应有
+2)mL,应有![]() :(
:(![]() +2)=6:8,解得
+2)=6:8,解得![]() =6mL,故
=6mL,故![]() (NO2):
(NO2):![]() (NH3)=6∶14=3∶7
(NH3)=6∶14=3∶7
12.D解析:A表现了HNO3的氧化性;B表现了HNO3的酸性;C主要表现HNO3的不稳定性。
13.A解析:B.王水指的是浓HNO3和浓盐酸按溶液体积之比为1:3所得的混合物。
C.硝酸与金属反应时,被还原的一般是指+5价氮,得到的还原产物是NO2、NO、N2O或N2等。
D.常温下,浓HNO3可使Fe和Al等金属发生钝化现象,故B、C、D均是错误的说法。
14.C解析:铜与稀硫酸不反应,但加入KNO3后,由于溶液中有H+存在,故会发生如下反应:
3Cu+8H++2NO![]() 3Cu+2NO↑+4H2O。
3Cu+2NO↑+4H2O。
加入Fe2(SO4)3,也会使铜粉的质量减少,但无气体逸出,故答案选C。
15.D解析:应用守恒法,反应中消耗的HNO3的物质的量应是转化成Cu(NO3)2和生成的NO![]() (NO和NO2)气体中N原子的物质的量之和:即
(NO和NO2)气体中N原子的物质的量之和:即![]() ,故答案选D。
,故答案选D。
16.C 解析:A.Cu~4HNO3(浓)~Cu(NO3)2~2NO2
B.Cu~HNO3(稀)~Cu(NO3)2~NO
C.CuO~2HNO3~Cu(NO3)2~H2O
由以上关系式可以看出:C.既节约原料,同时又不产生有毒气体。D.成本太高亦不可采用。故C为最好的办法。
17.D解析:Cu与稀硫酸不反应,在加热条件下铜和浓硫酸发生反应的化学方程式为:
Cu+2H2SO4(浓)![]() CuSO4+SO2↑十2H2O
CuSO4+SO2↑十2H2O
参加反应的H2SO4有一半被还原,在Cu与浓H2SO4的反应过程中,浓硫酸浓度逐渐降低,变成稀H2SO4时反应会停止,所以0.9molH2SO4与足量铜片反应时,被还原的H2SO4小于0.45mol。
点评:浓度不同,发生的化学反应不同,在具体分析、计算时应注意。
18.(1)C+2H2SO4(浓)![]() 2SO2↑十CO2↑十2H2O↑
2SO2↑十CO2↑十2H2O↑
(2)④→②→①→③
(3)验证产物气流中是否有SO2将SO2全部氧化吸收确证产物中SO2已被B瓶溶液全部氧化
(4)无水CuSO4(或变色硅胶)水蒸气由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前
(5)澄清石灰水CO2
解析:木炭与浓硫酸加热反应,生成CO2和SO2。CO2和SO2都跟澄清石灰水中的Ca(OH)2反应,生成CaSO3和CaCO3使澄清石灰水变浑浊,这相互干扰鉴别。在SO2、CO2混合气体中,首先用品红可检查SO2存在,然后将SO2氧化去除,再用澄清石灰水检验CO2的存在。
点评:品红是鉴别SO2的试剂,CO2不与品红作用。CO2和SO2在化学性质上有许多相似处:都是酸性氧化物;都能溶于水得酸;都与Ca(OH)2反应生成沉淀,通入过量的CO2或SO2时,生成的CaCO3、CaSO3沉淀溶解,变成Ca(HCO3)2、Ca(HSO3)2,溶液重新变澄清。CO2中“C”为高价,SO2中“S”为中间价,都可被还原为低价,因此,CO2、SO2有氧化性。