新课标高一化学同步测试(B)
第二节 几种重要的金属化合物
一、选择题:(本题共11小题,每小题5分,共55分)
1.下列说法中不正确的是( )
A.Na2CO3比NaHCO3易溶于水
B.Na2CO3比NaHCO3稳定
C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应得CO2的物质的量之比为2:1
2.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A.分别加热这两种固体物质,并将生成的气体通人澄清的石灰水中
B.分别在这两种物质的溶液中,加入CaCl2溶液
C.分别在这两种固体中,加入同浓度的稀盐酸
D.分别在这两种物质的溶液中,加入少量澄清的石灰水
3.把CO2通入含NaOH0.8g的碱溶液中,将产物在减压条件下蒸干后,得固体1.37g,则通入CO2的质量是( )
A.0.44g B.0.88g C.0.66g D.都不是
4.有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>甲=丙 D.甲=乙=丙
5.实验室需要使AlCl3溶液中的Al3+离了全部沉淀出来,适宜用的试剂是( )
A.NaOH溶液 B.Ba(OH)2溶液
C.盐酸 D.氨水
6.有200mL氯化镁和氯化铝的混合溶液,其中![]() (Mg2+)为0.2mol·L-1,
(Mg2+)为0.2mol·L-1,![]() (Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为( )
(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为( )
A.40mL B.72mL C.80mL D.128mL
7.在![]() Lal2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体
Lal2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体![]() g,溶液中SO
g,溶液中SO![]() 的物质的量浓度是( )
的物质的量浓度是( )
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
8.证明溶液中是否有Fe2+,其操作正确的顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A.①② B.②③ C.①②③ D.③②
9.能使铁溶解,但不能生成沉淀的溶液是( )
A.稀H2SO4 B.FeCl3溶液 C.CuSO4溶液 D.FeSO4溶液
10.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
D.只需滴加KSCN溶液
11.在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是( )
A.Fe B.FeO C.Fe(OH)3 D.Fe2O3
二、填空题:(18分)
12.往一金属易拉罐内(内空)放入一满角匙的某白色晶体,摇动几下后,立即注入50mL6mol·L-1氢氧化钠溶液,用胶布密封罐口。过一段时间后,罐壁变瘪;再过一段时间后,瘪了的罐壁又重新鼓起。
(1)要产生上述实验现象,做易拉罐的金属是______;往罐内加入的白色晶体是______;
(2)罐壁变瘪的原因是______,反应方程式是______;
(3)罐再度鼓起的原因是______,反应方程式是______。
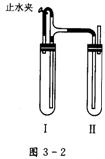 三、实验题:(14分)
三、实验题:(14分)
13.用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_______。
方法二:在如图3-2装置中,用NaOH溶液、铁屑、稀NaSO4等试剂制备。
(1)在试管I里加入的试剂是________。
(2)在试管Ⅱ里加入的试剂是________。
(3)为了制得白色Fe(OH)2沉淀,在试管工和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________。
四、计算题:(13分)
14.在氯化铁和氯化铜的混合溶液中,加入过量的Fe粉,若充分反应后溶液的质量没有改变,则原混合溶液中Fe3+和Cu2+物质的量之比为多少?
答案及详解:
1.D解析:NaHCO3与石灰水反应时,反应物的量不同,产物也不相同,但不管以何种比例混合,都有CaCO3生成。当加入少量石灰水时,反应方程式为:2NaHCO3+Ca(OH)2![]() Na2CO3+CaCO3↓+2H2O;当加入过量的石灰水时,反应方程式为:NaHCO3+Ca(OH)2
Na2CO3+CaCO3↓+2H2O;当加入过量的石灰水时,反应方程式为:NaHCO3+Ca(OH)2![]() NaOH+CaCO3↓+H2O。故C正确。物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应可得等量的CO2,故D不正确。
NaOH+CaCO3↓+H2O。故C正确。物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应可得等量的CO2,故D不正确。
2.D 解析:A中能产生气体且能使澄清石灰水变浑浊的是NaHCO3;B中有白色沉淀生成的是Na2CO3;C中反应速度快(剧烈)的是NaHCO3;D中两者均可与Ca(OH)2反应产生白色沉淀,故无法用于鉴别。
3.C解析:0.8gNaOH若全部转化成Na2CO3,则其质量为1.06g<1.37g;若全转化成NaHCO3,则其质量应为1.68g>1.37g。故NaOH吸收CO2时实际上生成了Na2CO3(![]() mol)和NaHCO3(
mol)和NaHCO3(![]() mol)的混合物。依Na原子守恒,得2
mol)的混合物。依Na原子守恒,得2![]() +
+![]() =0.02,且有:106
=0.02,且有:106![]() +84
+84![]() =1.37,解得
=1.37,解得![]() =0.005mol,
=0.005mol,![]() =0.01mol,故通人CO2的物质量为
=0.01mol,故通人CO2的物质量为![]() +
+![]() =0.015mol,质量为0.015mol×44g·mol-1=0.66g。
=0.015mol,质量为0.015mol×44g·mol-1=0.66g。
4.D解析:由题给条件,可知将甲蒸发掉一半水分,溶质的量并未发生变化,故完全反应时消耗的盐酸应与丙相同,甲丙很容易判断。由于存在如下关系式:2NaOH~Na2CO3~2HCl,可知向乙中通入量CO2后部分NaOH变为Na2CO3,而生成的Na2CO3在与盐酸反应时会消耗与NaOH变质前等量的盐酸,故完全反应后,所需盐酸溶液的体积应是相等的,即甲=乙=丙。
5.D解析:因为Al(OH)3溶于强酸、强碱,而不溶于弱碱,所以选D。
6.C解析:欲使Mg2+全部转化成沉淀并从溶液中分离出来,应向溶液中加入过量的NaOH溶液,使Mg2+、Al3+全部沉淀后,再使Al(OH)3恰好溶解。设![]() (Al3+)=
(Al3+)=![]() mol·L-1,则根据电荷守恒:
mol·L-1,则根据电荷守恒:
3![]() +2
+2![]() (Mg2+)
(Mg2+)![]()
![]() (Cl-),即3
(Cl-),即3![]() +2×0.2=1.3,
+2×0.2=1.3,![]() =0.3mol·L-1。
=0.3mol·L-1。
设NaOH溶液的体积为![]() mL,
mL,
则根据关系式:Mg2+![]() 2OH-
2OH-
0.2×0.22×0.2×0.2
Al3+![]() 4OH-
4OH-
0.3×0.24×0.3×0.2
得2×0.2×0.2+4×0.3×0.2=4×![]() ,即
,即![]() =80Ml。
=80Ml。
7.D解析:依题意,最后所得固体为Al2O3,其物质的量为![]() mol,故原
mol,故原![]() LAl2(SO4)3溶液中含SO
LAl2(SO4)3溶液中含SO![]() 的物质的量为(
的物质的量为(![]() ×3)mol,
×3)mol,
![]() (SO
(SO![]() )=
)=![]() =
=![]() mol.L-1,所以答案选D。
mol.L-1,所以答案选D。
8.D解析:滴加少许KSCN溶液,无红色出现;再加少许氯水后若立即出现红色,则证明原溶液中一定存在Fe2+。
9.AB
解析:Fe+H2SO4![]() FeSO4+H2↑
FeSO4+H2↑
2FeCl3+Fe![]() 3FeCl2
3FeCl2
Fe+CuSO4![]() FeSO4+Cu
FeSO4+Cu
FeSO4溶液不能溶解Fe,故答案选A、B。
10.B解析:先加KSCN溶液若不变红,则可证明无Fe3+;再滴加氯水立即呈红色,则可证明原溶液中有Fe2+。Fe2+遇SCN—无明显变化,滴加氯水后,Fe2+被氧化生成Fe+,Fe3+与SCN-结合使溶液变红了,故B是正确的实验方法。
11.D 解析:将一小块金属钠投入FeSO4溶液中,会发生如下反应:2Na十2H2O=2NaOH+H2↑;FeSO4+2NaOH![]() Fe(OH)2↓+Na2SO4。Fe(OH)2沉淀不稳定,容易被氧化:4Fe(OH)2+O2+2H2O
Fe(OH)2↓+Na2SO4。Fe(OH)2沉淀不稳定,容易被氧化:4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3。滤出的Fe(OH)3沉淀再灼烧,发生的反应是:
4Fe(OH)3。滤出的Fe(OH)3沉淀再灼烧,发生的反应是:
2Fe(OH)3![]() Fe2O3+3H2O。所以,最终所得的固体物质是Fe2O3。
Fe2O3+3H2O。所以,最终所得的固体物质是Fe2O3。
12.(1)Al 干冰
(2)干冰汽化时排出了罐内空气,当加入NaOH溶液后,CO2被吸收,使罐内气压小于大气压,故易拉罐变瘪CO2+2NaOH![]() Na2CO3+H2O
Na2CO3+H2O
(3)过量的NaOH溶液与铝制罐反应产生H2,使罐内压强增大到大于大气压,故罐再度鼓起2Al+2NaOH+2H2O=2NaAlO2十3H2↑
13.方法一:(1)稀H2SO4、铁屑(2)煮沸(3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀H2SO4、铁屑(2)NaOH溶液(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹(4)试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入
解析:方法一中根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4和铁屑;蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,因此可采用煮沸法除去O2。为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的。
方法二的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气。确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NAOH溶液中去,从而使产生的白色Fe(OH)2沉淀在H2的还原性气氛中得以较长时间保持。
点评:这是一道与Fe(OH)2的制备原理有关的题目,采用了创新的实验手法。对此类题目的完美解答,有赖于对基础知识的扎实掌握,对有关实验原理和仪器的熟知程度,并需要大胆的开拓和创新精神。
14.2:7
解析:在FeCl3和CuCl2的混合溶液中加入过量的Fe粉后,Fe粉会将Fe3+和Cu2+全部消耗掉。Fe3+与Fe反应会使溶液增重,Cu2+与Fe反应会使溶液减重。依据题意,若反应前后溶液的质量没变,则这两个反应增重与减重必然相等才能符合题意。
设反应前Fe3+为x mol,Cu2+为![]() mol,
mol,
2Fe3+十Fe![]() 3Fe2+ 增重
3Fe2+ 增重
2 3 56
x 28 x
Cu2+十Fe![]() Fe2++Cu 减重
Fe2++Cu 减重
1 1 8
![]() 8
8![]()
由28 x=8![]() 得x:
得x:![]() =2:7
=2:7
所以原混合溶液中Fe3+和Cu2+的物质的量之比为2:7