 高一化学上期期末复习试卷
高一化学上期期末复习试卷
试题一![]()
说明:1、考试时间:90分钟 总分:108分
2、可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Cu-64 Fe-56
第一卷 选择题(共51分)
一、选择题:(本题包括15小题,每小题2分,共30分,每小题只有一个选项符合题意)
1、2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球—科学发展”。下列行为中不符和这一主题的是:
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃 D.节约能源,提高能源利用率
2、下列类型的反应中,生成物中肯定有单质生成的是:
A.分解反应 B.复分解反应 C.化合反应 D.置换反应
3、向紫色石蕊试液中加入过量Na2O2粉末,振荡,正确的叙述是:
A.溶液仍为紫色 B.最后溶液变蓝色 C.最后溶液褪色 D.最后溶液变红
4、下列有单质生成的反应中,化合物作还原剂的:
A.Zn+H2SO4=ZnSO4+H2↑ B.Br2+2KI=2KBr+I2
C.2Na+2H2O=2NaOH+H2↑ D.CuO+2HCl=CuCl2+H2O
5、氧化钠与过氧化钠的共同之处是:
A.均是淡黄色固体 B.均是碱性氧化物 C.均能与水反应生成碱 D.均能与二氧化碳反应放出氧气
6、已知反应:①A2 + 2B-= 2A-+B2;②B2 + 2C- = 2B- + C2;③C2 + 2D- = 2C- + D2,则
A-、B-、C-、D-还原性的正确顺序是:
A.A-﹥B-﹥C-﹥D- B.D-﹥C-﹥B-﹥A- C.A-﹥D-﹥B-﹥C- D.D-﹥B-﹥A-﹥C-
7、下列反应属于吸热反应的是:
A.Ba(OH)2·8H2O晶体和NH4Cl混合搅拌 B.盐酸和氢氧化钠混合
C.锌放入稀硫酸中 D.硫和氧气的反应
8、下列说法错误的是:
A.H+的氧化性比Cu2+强 B.H2O既可作氧化剂又可作还原剂
C.Fe2+既有氧化性又有还原性 D.Na的还原性比Mg强
9、设![]() 为阿伏加德罗常数,下列说法中正确的是( )
为阿伏加德罗常数,下列说法中正确的是( )
A.![]() 个氢气分子所占的体积为22.4L B.
个氢气分子所占的体积为22.4L B.![]() 个二氧化碳分子的质量为88g
个二氧化碳分子的质量为88g
C.0.1mol/L 的NaCl溶液中,![]() 与
与![]() 离子总数为
离子总数为![]() D.17g NH3中所含原子数为4
D.17g NH3中所含原子数为4![]()
10、下列叙述正确的是:
A.氯化钠溶液在电流作用下电离成钠离子和氯离子所以能导电
B.二氧化硫的水溶液能导电,所以二氧化硫是电解质 C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.强电解质溶液的导电能力一定强于弱电解质溶液
11、有四位同学分别对四种溶液中所含的离子进行检测,所得结果如下,其中所得结果错误的是:
A.K+、Na+、Cl-、NO3-B.OH-、CO32-、Cl-、K+C.Ba2+、Na+、OH-、NO3- D.Cu2+、NO3-、OH-、Cl-
12、下列各组比较,不正确的是:
A.碱性:LiOH<NaOH<KOH B.氧化性:Na+>K+>Rb+ C.还原性:Li>Na>K D.熔点:Li>Na>K
13、下列反应的离子方程式正确的是:
A.硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ B.铁和稀硝酸反应:Fe + 2H+ = Fe2+ + H2↑
C.碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ D.二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O=2HCO3-
14、浓盐酸具有的化学性质是:
A.只有酸性 B.只有氧化性 C.只有还原性 D.有酸性、还原性、氧化性
15、用光洁的铂丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则下列有关叙述正确的是:
A.一定含Na+,也可能含K+ B.只含有Na+
C.可能含Na+或K+中的一种 D.既含有Na+,又含K+
二、选择题:(本题包括7小题,每小题3分,共21分,每小题只有一个选项符合题意)
16、将CO2分别通入下列各溶液中,不可能产生沉淀的是:
A.CaCl2溶液 B.石灰水 C.饱和Na2CO3溶液 D.Ba(OH)2溶液
17、重铬酸铵(NH4)2Cr2O7是一种受热易分解的盐,若是发生氧化还原反应而分解,下列各组对重铬酸铵受热分解产物的判断,可能符合事实的是:
A.CrO3+NH3+H2O B.Cr2O3+ NH3+H2O C.CrO3+N2+H2O D.Cr2O3+N2+H2O
18、下列反应可以用同一离子方程式表示的是:
A.HCl+Na2CO3;HCl+NaHCO3 B.NaOH+HCl ;Ba(OH)2+H2SO4
C.BaCl2+H2SO4 ; Ba(OH)2+Na2SO4 D.CaCO3+HCl ; Na2CO3+H2SO4
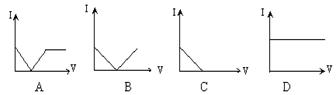 19、向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,
19、向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,
溶液的导电性(以电流I表示)和滴入的稀硫酸的体积(用V表示)间的关系正确的是:
20、M2O7x-离子和S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+= 2M3++3S↓+7H2O则M2O7x-离子中M的化合价是:
A.+2 B.+3 C.+4 D.+6
21、下列反应中,反应物里各种元素都参加氧化还原反应的是:
A.HgS + O2 ![]() Hg + SO2 B.CuO + CO
Hg + SO2 B.CuO + CO ![]() CO2 + Cu
CO2 + Cu
C.Cl2 + 2NaOH = 2NaCl + NaClO + H2O D.Mg + 2HCl = MgCl2 + H2↑
22.用下列方法均可制得氧气:
(1)![]() (2)
(2)![]()
(3)![]() (4)
(4)![]()
若要制得相同质量的氧气,反应中电子转移数目之比为:
A.3:2:1:4 B.1:1:1:1 C.2:1:2:2 D.1:2:1:1
化学试题答题卷 第一卷 选择题(共51 分)
一、选择题:(本题包括15小题,每小题2分,共30分)二、选择题:(本题包括6小题,每小题3分,共21分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
第二卷 非选择题(共57分)
三、填空题(33分)
23、(6分)将下列物质的序号填入相应的空格中:
⑴Ag ⑵ Br2(液) ⑶ Na2O ⑷ SO2 ⑸ NH3·H2O ⑹氢硫酸
⑺HCl ⑻熔融NaCl ⑼Ba(OH)2 ⑽酒精 ⑾澄清石灰水
 属于电解质的是
, 属于非电解质的是
,
属于电解质的是
, 属于非电解质的是
,
24、(6分)向Na2CO3 的浓溶液中逐滴加入稀盐酸直到不再产生CO2 气体为止。则此过程中,溶液的碳酸氢根离子浓
度变化趋势可能是:A.逐渐变小, B.逐渐增大, C.先是逐渐增大后减小, D.先是逐渐减小后增大。正确的选
择是( )
用离子方程式表示你的选择理由
25、(5分)已知氧化亚铁与浓硫酸共热发生反应生成硫酸铁、二氧化硫和水,请出写出此反应的化学方程式并配平 ;
在此反应中硫酸表现出的性质是: 。
26、(8分)某银白色固体A放在空气中可氧化成白色固体B;将A点燃,火焰呈黄色,生成浅黄色固体C;A、B、C均可跟无色液体D反应,生成碱性物质E;其中A跟D反应时还可生成可燃性气体F,C跟D反应时则可生成另一种气体G;F和G混合后遇火可剧烈反应而发生爆炸并生成D。
(1)、写出下列物质的化学式:
C: ,D: ,E: ,G: 。
(2)、写出A、C分别与D,反应的化学方程式:
27、(8分)只选用一种试剂鉴别NaNO3、Ba(HCO3)2、BaCl2、Na2CO3四瓶无色溶液,应选用 做试剂,
有关的离子方程式是:
⑴
⑵
⑶ 。
四、实验题(9分)
28.(4分)现有两瓶失去标签的稀溶液,只知道是 Na2CO3 和KHCO3两瓶溶液,请用两种方法确证。
29、(5分)实验室欲配制80mL 2mol/L的KCl溶液,就配制该溶液的过程,请回答:
(1)不需要的仪器是 ;A.烧杯 B.100mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F. 50mL容量瓶
(2)配制时应称取KCl g;
(3)下列操作的顺序是(用字母表示) ;A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(4)若容量瓶未干燥即用来配制溶液,实验结果将 ,若定容时俯视刻度线,
实验结果将 。
五、计算题(15分)
30、(9分)试样X由氧化亚铁和氧化铜组成,取质量相等的两份式样进行下图所示实验:
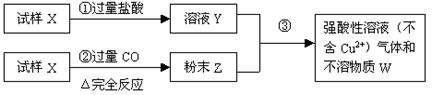
⑴ 写出步骤 ③发生的全部反应的离子方程式:
⑵ 若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜为多少克(用m表示)。
31、(6分) (1)在标准状况下,将4.2gNaHCO3和过量的200ml HCl制CO2,理论上制备CO2多少L?
(已知:NaHCO3+ HCl=NaCl+ H 2 O+ CO2 ↑)
(2)实际上由于一部分CO2溶解在反应后的混和溶液中,收集的CO2气体减少,已知每升溶液能溶解CO2 1.2L,则实际收集CO2多少升?(假设溶液体积变化忽略不计)
(3)如果某学生将实际质量为13.2g的NaHCO3错误地放在托盘天平的右盘上进行称量(5克以下用游码),根据他的称量结果进行计算,这些NaHCO3加热分解放出CO2的物质的量为多少?
垫江师范高2010级高一化学上期期末复习试题一
化学试题参考答案
一、选择题:(本题包括15小题,每小题2分,共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | C | B | C | B | A | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 | D | C | D | C | D | D | A |
二、选择题:(本题包括6小题,每小题3分,共21分)
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | A | D | C | A | D | A | C |
三、填空题(33分)
23、属于电解质的是:⑶⑸⑺⑻ ⑼ 属于非电解质的是:⑷ ⑽
24、C; CO32- + H+ = HCO3- , HCO3- + H+ =H2O + CO2↑
25、2FeO + 4H2SO4(浓) ![]() Fe2(SO4)3
+ SO2↑+ 4H2O;酸性和氧化性
Fe2(SO4)3
+ SO2↑+ 4H2O;酸性和氧化性
26、(1)C:Na2O2 ,D:H2O ,E:NaOH ,G:O2
(2)2Na + 2H2O = 2NaOH + H2↑;2Na2O2 + 2H2O = 4NaOH + O2↑
27、稀硫酸或NaHSO4溶液
(1)Ba2+ + 2HCO3- + 2H+ + SO42- = BaSO4↓ + 2H2O + 2CO2↑
(2)Ba2+ + SO42- = BaSO4↓
(3)CO32- + 2H+ = H2O + CO2↑
四、实验题(9分)
28、(4分)答案合理均可
29、(5分)(1)F (C F) 。(2) 14.9 g。(3) B E A G C (F) D F 。(4) 无影响 , 偏大。
五、计算题(15分)
30、(9分)(1)Fe + Cu2+ = Fe2+ + Cu ; 2H+ + Fe = Fe2+ + H2↑
(2)5m/8 g
31、(6分)(1)1.12升(3分)(2)0.88升(3分)(3)0.1mol(4分)
重庆市垫江师范化学组 李昌德