高一化学上期末试卷
命题、审核:陈青建
(满分100+20分,考试时间:90分钟)
可能用到的相对原子质量:O:16 C:12 H:1 Cu:64
N:14 S:32 Na:23 Cl:35.5
第Ⅰ卷
一、选择题(每小题2分,共44分,每小题只有一个正确选项)
1.下列物质属于电解质的是
A. 盐酸 B. 纯碱 C. 碘酒 D. 二氧化碳
2.将下列物质按酸、碱、盐分类排列,正确的是
A.次氯酸、纯碱、石膏 B.硫酸、烧碱、小苏打
C.盐酸、乙醇、氯化钠 D.醋酸、漂白粉、石灰石
3.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为
A.元素 B.单质 C.分子 D.氧化物
4.我国城市环境中的大气污染物主要是
A.NH3、CO2、NO、雾 B.HCl、SO2、N2、粉尘
C.SO2、NO2、CO、烟尘 D.CO2、Cl2、O2、酸雨
5.在常温常压下,下列各组气体不能共存的是
A、SO2与O2 B、NO与O2 C、CO与O2 D、O2与H2
6.能与AgNO3溶液反应生成白色沉淀的是:
A.KClO3溶液 B.KBr溶液 C.氯水 D.KI溶液
7.下列说法正确的是
A.原子核都是由质子和中子构成的
B.不同元素原子的质量数一定不相等
C.质子数决定元素的种类,质子数和中子数决定原子的种类
D.质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同
8.为了防止吸进氯气中毒,可以用浸有某种物质水溶液的毛巾捂住鼻子,该物质最适宜采用
A、氢氧化钠 B、醋酸 C、NH3 D、纯碱
9.绿色食品是指
A、在原料生产、加工各工序均为安全、无污染的食品
B、含有叶绿素的食品
C、在加工和包装上干净、卫生的食品
D、绿颜色的食品
10.对于某些离子的检验及结论一定正确的是
A. 溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO![]()
B.溶液中加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO![]()
C.溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液中一定有Ba2+
D.溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定有NH![]()
11. 将铜粉放入稀硫酸中,加热无明显现象发生。但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是 ①.Fe2(SO4)3 ②ZnSO4 ③.KNO3 ④NaCl
A. 只有① B. ①② C. ①③ D. ①④
12.表示下列反应的离子方程式正确的是
A.氢氧化钡溶液与稀硫酸反应 Ba2++2OH—+2H++SO42—=BaSO4¯+2H2O
B.稀盐酸与碳酸钙反应 CO32— + 2H+ = CO2 + H2O
C.金属钠投入水中 Na + H2O = Na+ + OH—+ H2↑
D.醋酸溶液与氢氧化钠溶液反应 H+ + OH— = H2O
13.下列实验中,溶液颜色不会发生变化的是:
A. Cl2通入红墨水中 B.碘酒滴入淀粉溶液
C.溴蒸气通入酒精溶液中 D.Cl2通入NaOH溶液中
14. 浓硫酸和2mol/L的稀硫酸,在实验室中敞口放置。它们的质量和放置天数(横坐标)的关系如右图,分析a.b曲线变化的原因是
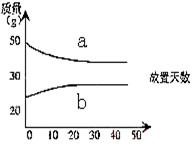 A.a升华、b冷凝
A.a升华、b冷凝
B.a挥发、b吸水
C.a蒸发、b潮解
D.a冷凝、b吸水
15. 能大量共存于同一溶液中的离子组是:
A.Ba2+,Na+ ,CO32-,Cl- B. NO3-,Na+,H+,Cl-
C.Ag+,K+ ,Br-,SO42- D. Ba2+,NH4+,NO3-,OH-
16.不用任何试剂而只用滴管和试管无法鉴别的一组溶液是
A.氯化铁溶液和氯化铜溶液 B.硫酸钠溶液和氯化钠溶液
C.氯化铝溶液和氢氧化钠溶液 D.硫酸氢钠溶液和碳酸钠溶液
17.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是
A.NaOH B.NH3·H2O C.AgNO3 D.BaCl2
18. 区别稀盐酸和氯化钠溶液应选用的方法是
A.滴加硝酸银溶液 B.滴加碳酸钠溶液
C.滴加淀粉碘化钾溶液 D.滴加酚酞试液
19.下列实验操作中正确的是
A.用量筒量取16.25 mL的稀硫酸
B.在托盘天平的托盘上放置相等质量和大小的纸片后称量氢氧化钠固体
C.分液时,分液漏斗中下层液体从下端管口放出,上层液体从上口倒出
D.配制1mol· L-1食盐溶液时,将称取的食盐放入容量瓶中加适量的水溶解
20.NA代表阿伏加德罗常数,下列说法正确的是
A.常温常压下,4g甲烷所含的质子数目为2.5NA
B.在20℃ 、1.01×105Pa条件下,11.2L氮气所含的原子数目为NA
C.0.2mol· L-1的Na2 SO4 溶液中含Na+ 0.4mol
D.17g氨气所含电子数目为17NA
21.下列溶液中,Cl— 的物质的量浓度与50mL 1mol·L-1 AlCl 3溶液中Cl—浓度相等的是
A.150mL 1mol·L-1 NaCl溶液 B.25mL 3mol·L-1 MgCl2溶液
C.150mL 3mol·L-1 KClO3溶液 D.75mL 1mol·L-1 FeCl3溶液
22.在一定温度和压强下,将一支容积为15mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A、3.75mL B、5mL C、7.5mL D、8.75mL
![]() 二、填空题(共39分)。
二、填空题(共39分)。
23、(6分)(1)0.4 mol OH-的质量为 ,其中含有 个电子;
(2)质量相同的H2、NH3、SO2、NO2四种气体中,含有分子数目最少的是 ,
在相同温度和相同压强条件下,体积最大的是 。
(3)在 mL 0.2 mo1·L-1 NaOH溶液中含1g溶质;配制50mL0.2 mo1·L-1 CuSO4溶液,需要CuSO4·5H2O g。
24、(6分)配平化学方程式,并回答问题:
□NaI + □HNO3 == □I2 + □NaNO3 + □NO↑ + □H2O;
氧化剂是 ,还原产物是 ;
反应中有1.2 mo1的电子发生转移,则可生成标准状况下的NO气体
mL。
25(4分)(1)根据离子方程式改写成化学方程式:
①CO32- + 2H+ == CO2 ↑+ H2O
②Fe2O3+6H+=2Fe3++3H2O
(2))写出下列物质在水溶液里的电离方程式
①碳酸氢钠: ②醋酸:____ ___ _
26、(6分)除去下列括号中的杂质,写出所用试剂的化学式与反应的离子方程式:
(1)NaHCO3(Na2CO3),所加试剂 ,离子方程式 。
(2)Cl-( SO42-) ,所加试剂 ,离子方程式 。
(3)Fe2O3 (SiO2) 所加试剂 ,离子方程式 。
27、(8分)有A、B、C、D四瓶失去标签的无色溶液,它们分别是氯化镁溶液、盐酸、硫酸铵溶液和氢氧化钡液中的一种,其相互关系如下图所示:
试推断:
|
![]()
![]() 白色沉淀
白色沉淀
![]()
|
|
![]()
![]() 白色沉淀
沉淀不溶解
白色沉淀
沉淀不溶解
(均填写化学式)A是 ; B是 ;
C是 ; D是 。
28.(9分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
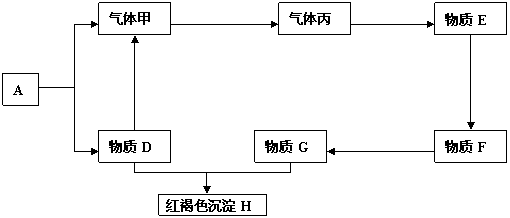 黄绿色气体乙
水
黄绿色气体乙
水
②
水 金属B 金属C
① ③ ④
黄绿色气体乙
⑥ ⑤
请根据以上信息回答下列问题:
(1)写出下列物质的名称:A 、 C 、 E
(2)写出下列反应化学方程式:
反应③ ;
反应⑤ ;
反应⑥ 。
三、实验题(9分)。
29、海产品中常含有较多的碘元素,因此海边的居民很少患碘缺乏症。某化学兴趣小组的同学通过以下步骤提取海带中的碘:
a、将海带晒干后灼烧成灰,再加水浸泡后过滤;
b、取滤液(含碘离子)通入适量的氯气,得到含碘的水溶液;
c、往碘的水溶液中加入有机溶剂,经处理后得到碘的有机溶液;
d、将碘的有机溶液进行后期处理,得到碘晶体。
回答下列问题:
(1)、灼烧过程可在下列哪种仪器中进行 ;
A、坩埚 B、试管 C、烧杯 D、蒸发皿
(2)、过滤时用到的玻璃仪器有 ;
(3)、步骤b中发生反应的离子方程式为 ;
(4)、步骤c中所含操作过程的名称为 ,若以四氯化碳为溶剂,则分层后四氯化碳在 层(填上或者下),下列有机溶剂也可用来将碘水中的碘提取出来的是 。(填字母)
A、苯 B、汽油 C、酒精 D、醋酸
四、计算题(8分)。
30.使一定质量的锌与100mL、密度为1.84 g·cm-3 、质量分数为98%的浓硫酸充分反应。
(1)计算该浓硫酸的物质的量浓度;
(2)若锌完全溶解,同时生成标准状况下混合气体为33.6L,并将反应后的溶液稀释至1L,测得溶液中c(H+)为0.08mol·L-1,求混合气体中各组分的体积比。
附加题(20分)
 31.(10分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物和水已经略去。
31.(10分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物和水已经略去。
(1)若A与NaOH反应,既可只生成B, 又可只生成C,还可生成B+C。
①写出两种符合上述反应关系的A的分子式 、 .
②任选上述一种物质,写出有关离子方程式:
生成B的离子方程式为 ;
生成C的离子方程式为 。
(2) 若A与NaOH无论以何种物质的量比反应, 其产物必为B+C,则A的分子式可能是
(只写一种),R在A、 B 、C中的化合价必须满足的条件是 ,
该反应的离子方程式为 。
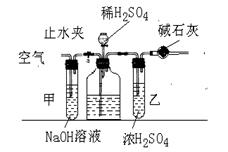 32. (10分)工业生产的纯碱中常含有少量的NaCl等杂质。下图是测定产品中碳酸钠质量分数的实验装置。实验步骤有(有的步骤可能重复):
32. (10分)工业生产的纯碱中常含有少量的NaCl等杂质。下图是测定产品中碳酸钠质量分数的实验装置。实验步骤有(有的步骤可能重复):
A.在干管中填满碱石灰,质量为mg;
B.取ng样品装入广口瓶中; C.检验装置的气密性;
D.缓缓鼓入空气数分钟,再称干燥管质量为wg;
E.关闭止水夹; F.打开止水夹;
G.缓缓加入稀硫酸到不再产生气体为止;
H.缓缓鼓入空气数分钟。
(1)正确操作顺序是(填写符号)
C 、 、F 、E 、G 、D
![]() (2)装置甲的作用是 ;装置乙的作用是
;
(2)装置甲的作用是 ;装置乙的作用是
;
(3)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是 ;
(4)溶液中碳酸钠的质量分数的计算式为: ;
(5)若去掉装置甲,测定结果为 ;若去掉装置乙,测定结果为 ;(填“偏大”、“偏小”、或“无影响”)
(6)请再设计一种测定碳酸钠质量分数的方案,并以简要的文字说明实验操作过程。
。
高一上期末化学试卷参考答案
一、选择题答题卡(共22×2=44分)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 选项 | B | B | A | C | B | C | C | D | A | D | C |
| 题序 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 选项 | A | D | B | B | B | A | B | C | A | D | D |
![]() 二、填空题(共39分)。
二、填空题(共39分)。
23、(6分,每空各1分)(1) 6.8g 、2.408×1024 (2) SO2 、H2 (3)125 、2.5
24、(6分) 6、8、3、6、2、4(2分) HNO3 、NO (2分) 8960(2分)
25(4分, 每空各1分)(1)① Na2CO3 + 2HCl == 2NaCl + CO2 + H2O(Na2CO3可为(NH4)2CO3 、 K2CO3 )
②Fe2O3+6 HCl=2Fe Cl 3+3H2O (HCl 可为HBr 、HNO3 H2SO4 )
(2)① NaHCO3 == Na+ +
HCO3__ (HCO3__ ![]() CO32- + H+ 不占分)
CO32- + H+ 不占分)
② CH3COOH ![]() CH3COO__ + H+
CH3COO__ + H+
26、(6分,每空各1分)(1)CO2 、CO32- + CO2 + H2O = 2 HCO3-
(2)BaCl2、Ba2+ + SO42- = BaSO4↓ (3)NaOH 、SiO2 + 2OH- = SiO32- + H2O
27、(8分)MgCl2 、 (NH4)2SO4 、 HCl 、 Ba (OH)2 (各2分)
28.(9分)(1)(各1分)A:钠 C:铁 E:盐酸
(2)(各2分)反应③:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
反应⑤:2FeCl2 + Cl2 == 2FeCl3
反应⑥:FeCl3+ 3NaOH == Fe(OH)3↓+ 3NaCl
三、实验题(9分)。
29、(9分)(1)A ;(1分) (2)漏斗、烧杯、玻璃棒;(2分,对1个不给分,对2个给1分,对3个给2分)
(3)、Cl2 +2 I — = I2 + 2Cl — (2分)
(4)、萃取(和分液)(1分) 、 下(1分) 、 A、B (2分)
四、计算题(8分)。
(1) 1000 mL·L-1 ×1.84 g·cm-3 × 98%
C(H2SO4)= ———————————————————
98g ·mol-1
= 18. 4 mol·L-1 …(2分)
(2)据题意:反应后c(H2SO4)为0.04mol·L-1,n(H2SO4)为0.04mol (1分)
Zn + 2H2SO4(浓) ![]() ZnSO4
+ SO2↑ + H2O
ZnSO4
+ SO2↑ + H2O
2n(SO2) n(SO2)
Zn + H2SO4(稀) = ZnSO4 + H2↑
n(H2) n(H2) (1分)
![]() 2n(SO2) +
n(H2) + 0.04mol
= 0.1L × 18.4mol·L-1
2n(SO2) +
n(H2) + 0.04mol
= 0.1L × 18.4mol·L-1
n(SO2) + n(H2) = (2分)
解得: n(SO2)=0.3mol n(H2)=1.2mol (1分)
则:V(SO2)∶V(H2)=0.3mol∶1.2mol=1∶4 (1分)
附加题(20分)
31. (10分) ⑴ ①![]() ;SO2 (每空1分) ②生成B的离子方程式为
;SO2 (每空1分) ②生成B的离子方程式为![]() ;( 2分)
;( 2分)
生成C的离子方程式为![]() (2分)
(2分)
⑵![]() ,(1分) R在A中的化合价处于B、C中化合价之间,(1分)
,(1分) R在A中的化合价处于B、C中化合价之间,(1分)
该反应的离子方程式为![]() 。(2分)
。(2分)
32. (10分)
(1)B H A F (2分)
![]() (2)吸收空气中CO2气体(1分) 吸收CO2气体中的水分(1分)
(2)吸收空气中CO2气体(1分) 吸收CO2气体中的水分(1分)
(3)使装置中的CO2气体全部排出,减少实验误差(1分)
(4)53(w-m)/22n(1分)
(5)偏大;(1分) 偏大(1分)
(6)称取一定质量的样品,加水溶解,滴加过量的氯化钡溶液,过滤,洗涤,干燥,称量。(2分)