![]() 高一化学上期第三次学月考试题
高一化学上期第三次学月考试题
化学试题
说明:
1、本试卷分第Ⅰ卷和第Ⅱ卷,共四道大题25道小题。考试时间90分钟,满分108分。
2、答题前,先将班级、姓名、座号等正确填写在答卷指定的区域内。所有试题的答案都必须工整书写在答卷规定的位置,否则无效。
3、考试结束后将第二卷交回,第一卷自己保留,评讲时用。
4、可能需要的相对原子质量数据H—1 O—16 C—12 N—14 Na—23 S—32 Cl—35.5 Cu—64 Zn—65 Ag-108
第Ⅰ卷 (选择题 共48分)
一、选择题(本题包括21小题,每小题只有一个选项符合题意,2×21=42分。)
1、下列对于“摩尔”的理解正确的是
A.摩尔是国际科学界广泛使用的一种物理量 B.NA 约等于6.02×1023
C.摩尔是物质的量的单位,简称摩,符号为mol D.10mol氧约含有6.02×1024个氧分子
2、关于Na的描述正确的是( )
①Na在自然界既有游离态又有化合态存在
②Na比Cu活泼,因而Na可以从CuCl2溶液中置换出Cu
③实验室中少量的Na保存在煤油里 ④Na-K合金做原子反应堆的导热剂
⑤金属Na着火可以用泡沫灭火器救火 ⑥Na在空气中燃烧,主要产物是Na2O2
7向紫色石蕊溶液中加入过量的Na2O2粉末振荡,可观察到的现象为溶液中有气泡产生,溶液最终变为无色
A.①③④⑤⑥ B.③④⑥7 C. ③④ D.全部
3、由Na、Mg、Al三种金属中的两种组成的混合物共8g,跟足量盐酸反应,得到0.5g氢气,则此混合物中必定含有( )
A.Mg B.Na C.Al D.无法确定
4、在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是( ) (2007年高考全国理综卷II)
(A)Na2O (B)Na2O2 (C)Na2O和Na2O2 (D)Na2O2和NaO2
5、设NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol NH4+ 所含质子数为10NA B.10克氖气所含原子数约为6.02×1025
C.22.4 L H2所含的分子数可能为NA D.2.3克金属钠变为钠离子时得到电子数是0.1NA
6、多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含CuCl2,MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是( )
A.Cu B.H2 C.Mg D.不能确定
7、将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为( )
A.50mL B.50.5mL C.55mL D.59.5mL
8、在20℃时,在一刚性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室。左室充入氮气,右室充入氢气与氧气的混和气体,活塞恰好停留在离左端的1/5处(图1),然后引燃氢、氧混和气体,反应完毕后恢复至原来温度,活塞恰好停在中间(图2),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是( )
![]() A.3:1
B.4:5
A.3:1
B.4:5
C.2:1 D.7:2
9、相对分子质量为M的某物质在室温下的溶解度为Sg,此时测得饱和溶液的密度为dg/cm3,则该饱和溶液的物质的量浓度是 ( )
A、![]() mol/L B、
mol/L B、![]() mol/L C、
mol/L C、![]() mol/L D、
mol/L D、![]() mol/L
mol/L
10..在100℃时,3.6g CO和H2的混合气体与足量的氧气反应后通入装有足量Na2O2的反应管充分反应,已知CO和H2的质量比为5:1,则反应管增重( )
A.5.6 g B. 1.6 g C.3.2 g D.3.6 g
11.RO32—+2Rx+6H+=3R+3H2O是某同学作业中的一个离子方程式,其中Rx所带电荷模糊不清,若R所带电荷用x表示,则x应是( )
A.+ B.2- C.3+ D.4-
12、两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同:①.原子总数 ②.质子总数 ③.分子总数 ④.质量 ( )
A、①② B、②③ C、①③ D、②④
13、如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
14、能在溶液中大量共存的一组离子是
A.Cu2+、SO42-、OH—、K+ B.Na、CO32-、H+、Cl- C.H+、Cl-、NO3-、Ba2+ D.Ca2+、H+、CO32-、NO3-
15、密度为0.910 g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为( )
A.等于13.5% B.大于12.5% C.小于12.5% D.无法确定
16、将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为( )
 A.
A.![]() mol/L
B.
mol/L
B.![]() mol/L
mol/L
C.![]() mol/L
D.
mol/L
D.![]() mol/L
mol/L
第II卷(非选择题,共60分)
二、填空题(本题共4小题,共37分)
17.与16 g氧气所含分子数相同的氨气的质量是 g,与16 g氧气所含原子总数相同的氨气的质量是 g;在相同条件下,在5.6g氮气中应添加 g氨气所组成的混合气体与16g氧气所占的体积相等。(6分)
18(6分)(1)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,请写出此步反应的离子方程式
(2)再向以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式
(3) NaHSO4与Ba(OH)2以物质的量之比1:1混合,请写出此步反应的离子方程式
19(7分)将24.4gNaOH固体溶于水配成100ml溶液,其密度为1.219g/mL。
(1)该溶液中NaOH的物质的量浓度为 。
(2)该溶液中NaOH的质量分数为 。
(3)从该溶液中取出10ml,其中NaOH的物质的量浓度为 ,NaOH的质量分数为 ,溶液的密度为 ,含NaOH物质的量为 ,含Na+的数目约为 。
20.(3分)(1)同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为 ;同质量的氨和硫化氢气体的体积比为 ,其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 。(4分)
(2) 某固体仅由一种元素组成,其密度为5g·cm-3,用X射线研究该固体的结构表明,在棱长为1×10-7cm的立方体中含有20个原子,则此原子的摩尔质量为 (3分)
21、(4分)用双线桥标出下列反应的电子转移方向和数目:
KIO3+5KI +3H2SO4=3K2SO4+3I2+3H2O,氧化产物与还原产物的质量之比为: 。
三、实验题(本题共1小题,共8分)
22、实验室用Na2CO3·10H2O配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体________g。
(2)配制时应选用 mL的容量瓶,托盘天平、烧杯、药匙,还需要用到的仪器有 和 。
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式,这六项中的 。(填数字符号)
(4)若实验时遇到下列情况,将使溶液的浓度偏高、偏低或无影响。
A、加水定容时超过刻度线; 。 B、忘记将洗涤液转入容量瓶; 。
C、容量瓶洗涤后内壁有水珠而未作干燥处理; 。
D、定容、摇匀、静置后发现凹面低于刻度线,又加水至刻度线; 。
E、定容时俯视刻度线; 。
F、为加速固体溶解,可稍加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容: ;
四、推断题(本题包括2小题,共9分)
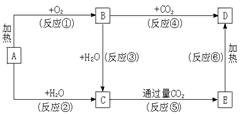
23、(6分)①下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
请填写下列空白:
(1)以上反应中,属于氧化还原反应的有___________。(填写编号)
(2)写出C→E反应的化学方程式 。
(3)写出E溶液与足量澄清石灰水反应的离子方程式
②某种干燥的粉末状混合物可能由Na2O、Na2CO3、Na2O2、NaCl、NaHCO3中的两种或几种组成(假设固体混合时不反应)。为确定其组成,现将少量样品投入足量的盐酸中,发现有气体a逸出,将气体a缓慢通过足量的NaOH溶液时,气体体积缩小(同温.同压),但仍有剩余。另取一定量的原混合物,在空气中加热至不再有气体产生时停止加热,冷却至室温后再称量,发现剩余固体的质量大于原混合物的质量。下列有关原混合物组成的叙述中,正确的是 ( )
A.一定含有Na2O,Na2O2,NaHCO3 B.一定含有Na2O和NaCl
C.一定不含有Na2CO3,Na2O D.一定含有Na2CO3,NaCl
五、计算题(本题包括2小题, 共13分)
24. (6分)将某碳酸钠和碳酸氢钠的混合物2.74g加热到质量不再变化时,剩余物质的质量为2.12g。
(1)求原混合物中碳酸氢钠的质量。
(2)若将原混合物溶于400ml某浓度的稀盐酸中,恰好完全反应,求该稀盐酸的物质的量的浓度。
![]() 解:
解:
25(6分)在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入盐酸,所加盐酸中HCl的物质的量(mol)与产生CO2气体的物质的量(mol)的关系如图所示 。试填写下列空白:
(1)两份NaOH溶液A和B的物质的量之比是 ,通入CO2气体的物质的量之比是 。
(2)与盐酸反应前,A溶液中的溶质是 ,其物质的量之比是 。
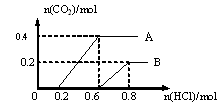 (3)与盐酸反应前,B溶液中的溶质是
,其物质的量之比是
。
(3)与盐酸反应前,B溶液中的溶质是
,其物质的量之比是
。
参考答案
[高一上期化学第一至三章,侧重第三章物质的量]
一..选择题【每题3分,48分】说明:请把的答案写在第I卷选择题答题栏上
CBBC C ABA ;B DBCA DCB
4[答案]C。[提示]HCl为0.04 mol。钠的氧化物若为Na2O,应为0.02 mol×62 g·mol-1 = 1.24 g;
若为Na2O2,应为0.02 mol×78 g·mol-1 = 1.56 g。现1.5 g,介于1.24~1.56之间,应为二者的混合物。
二.填空题(共30分)
17. 8.5 ,4.25 ,5.1(6分) ;
18. (6分) Ba2++ SO42-+ 2H+ + 2OH- = BaSO4↓ + 2H2O Ba2+ + SO42- = BaSO4↓
Ba2++ SO42-+ H+ + OH- = BaSO4↓ + H2O;
19. (共7分).(1)6.1mol/L (2)20%
(3)6.1mol/L ;20% ;1.219g/mL ;0.061mol ;0.061×6.02×1023 (每空1分)
※20 (7分)(1)(4分)1:2 ,2:1 ,3:1 ,2:3 (2) 150.5g/mol(不写单位扣2分) (3分)
21(4分) 得5e-
![]()
![]() (1) KIO3+ 5KI + 3H2SO4=3I2+3K2SO4+3H2O,,(2分)
(1) KIO3+ 5KI + 3H2SO4=3I2+3K2SO4+3H2O,,(2分)
失5×e- 氧化产物与还原产物的质量之比为:5:1。(2分)
三、实验题(本题共1小题,每空0.5分,共8分)
22.(1)14.3 (2)500,玻璃棒,胶头滴管。 (3)容量瓶上标有:①、③、⑤
(4)A、偏低。B、偏低。C、无影响。D、偏低。E、偏高。F、偏高
四、推断题(共9分)
23.(1)①②③④ (2)NaOH+CO2=NaHCO3(3)HCO3-+Ca2++OH-=CaCO3↓+H2O(6分)
A(3分)
五、计算题(共13分)
24 (6分) (1)1.68g(2)0.1mol。L-1
25(7分) (1)3:4 (1分), 2:1(1分) 。
(2) Na2CO3 、NaHCO3 (2分) 1:1 (1分)
(3) NaOH 、 Na2CO3 (2分) 2:1 (1分)
| |