高一化学下复习迎考模拟试题2
![]() 第六章 氧族元素 环境保护
第六章 氧族元素 环境保护
注:可能用到的相对原子质量:H-1,O-16,C-12,N-14,S-32,Cu-64,Na-23,Fe-56
(时间:90分钟,满分:108分)第I卷 (选择题: 48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
一、选择题(每小题只有一个正确答案,每小题3分,共51分)
1、现有以下几种措施:①对硫酸工业产生的尾气进行吸收处理,②对煤进行脱硫处理,③燃煤时鼓入足量空气,④开发清洁能源。其中能减少酸雨产生的措施的
A.①②③ B.②③④ C.①②④ D.①②③④
2、下列各组粒子中属于同位素的是
A.16O和18O B.H2O和D2O C.H2、D2 D.24Mg和24Na
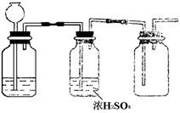 3、根据实验室制取某种干燥气体的装置图(右图),判断气体发生装置中的固体药品和液体可能是(
)
3、根据实验室制取某种干燥气体的装置图(右图),判断气体发生装置中的固体药品和液体可能是(
)
A.Zn和稀H2SO4 B.Na2SO3固体和浓H2SO4
C.FeS和稀HCl D.MnO2和浓HCl
4、下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
5、对于X—O—H型化合物而言,X是除H、O外的其他元素时,下列说法中正确的是
A. X—O—H的水溶液不能导电 B.当X是金属性很强的元素时,X—O—H一定是强碱
C. X—O—H一定是离子化合物 D. X—O—H一定是共价化合物
6、下列说法不正确的是
A.引起臭氧层空洞的原因是氟氯烃的大量使用和发动机废气的排放
B.可用铁罐贮运冷的浓硫酸C.医药上常用硫酸钡作X射线透视肠胃的内服药剂
D.硫酸铜晶体中加入浓硫酸,蓝色晶体变为白色粉末,是因为浓硫酸具有脱水性
7、下列物质按其颜色“赤橙黄绿蓝紫”的顺序排列的是
①.CuSO4·5H2O ②. AgI ③. 溴水 ④. FeSO4·7H2O ⑤. KMnO4溶液 ⑥.Cu2O
A.⑥③①②④⑤ B.①④⑤⑥③② C.⑥③①②⑤④ D .⑥③②④①⑤
8、向100毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量
A.小于0.9摩 B.等于0.9摩 C.在0.9摩与1.8摩之间 D.大于1.8摩水
9、下列五种有色溶液与SO2作用,均能褪色。其实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤淀粉碘溶液
A.①④ B.①②③ C.②③⑤ D.②③
10、下列说法中正确的是
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子 D.最外层有5个电子的原子都是非金属原子
11、下列说法正确的是
A.常温常压下,只有一种元素的单质呈液态 B.周期表中所有元素都是从自然界中发现的
C.常温常压下,气态单质的分子都是由非金属元素的原子形成的D.过渡元素不全是金属元素
12、能够说明硫的非金属性比氯弱的事实有:①Cl2与铁反应生成FeCl3,S与铁反应生成FeS;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度;
③将Cl2通入氢硫酸中可置换出硫;④常温时硫单质为固态而氯单质为气态。
A.①③ B.①②③ C.②④ D.①②③④
13、双氧水在医疗上可称为“绿色”外用消毒剂,下列关于H2O2的说法正确的是( )
 A.H2O2是共价化合物,具有杀菌消毒作用,是水的同素异形体
A.H2O2是共价化合物,具有杀菌消毒作用,是水的同素异形体
B.将H2O2加入酸性高锰酸钾溶液中,溶液的紫色褪去,说明双氧水具有漂白性;
C.H2O2不稳定,易放出O2,此时H2O2主要表现还原性;
D.久置的油画变黑,可用双氧水揩擦后又恢复原貌(PbS +4H2O2=PbSO4+4H2O),因为双氧水具有强氧化性。
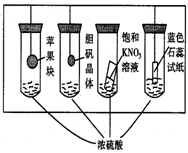
14、在下图所示的实验装置中,实验进行一段时间后,对观 察到的现象叙述不正确的是( )
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出 D.蓝色石蕊试纸变红
15、某溶液中加入过量稀盐酸,产生沉淀,过滤除去沉淀,往滤液中通入H2S气体,又产生沉淀,该溶液中含有下列哪组阳离子( )
A.Na+、NH4+、Ag+ B.Fe2+、Mg2+、Ag+ C.K+、Cu2+、Ag+ D.Ba2+、Al3+、Ca2+
16、、含FeS286%的黄铁矿燃烧时损失硫5%,由SO2转化为SO3时转化率为99%,问生产98 %的硫
酸1吨,需黄铁矿多少吨
A. 0.742吨 B. 0.85吨 C. 0.845吨 D. 1.484吨
(以上选择题答案务必答在第Ⅱ卷的答题栏中,否则不得分)
第Ⅱ卷 (非选择题:60分)
二、填空题(本题共28分)
17、(9分)(1)臭氧的化学式为 ,它和氧气的关系是
(2)用双氧水制取氧气的反应方程式
(3)C与浓硫酸反应的化学方程式
(4)在盛有淀粉KI溶液(用H2SO4酸化)的试管中,滴加少量的次氯酸钠溶液,会立即看到溶液变成蓝色,这是因为__________________的缘故,相应的离子方程式为__________________;在盛有淀粉和碘形成的蓝色溶液中,滴加Na2SO3溶液,又发现蓝色溶液逐渐消失,这是因为__________________的缘故,相应的离子方程式为 ________________________。对比上述两组实验所得结果,可得出ClO—、I2、SO42—的氧化性由强到弱的顺序为________________。
18、 (4分) 归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质/元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | – 218.4 | 113 | 452 | |
| 单质沸点(℃) | – 183 | 444.6 | 685 | 1390 |
| 主要化合价 | – 2 | – 2、+ 4、+ 6 | – 2、+ 4、+ 6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是______________________;(2)碲的化合价可能有__________________;
(3)硫、硒、碲的氢化物的稳定性由强至弱的顺序是__________________(填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质。
*19、 (5分)一种无色溶液具有以下性质:(1)能使石蕊试纸变红;(2)加热时产生无色有刺激性气味气体,蒸干时无残渣;(3)能使溴水褪色;(4)加Ba(OH)2溶液有白色沉淀生成,该沉淀溶于稀盐酸。此无色溶液是_______。写出有关的化学方程式____________________;___________________;______________________________;______________________________。
20、(6分)将下列环境问题所对应的主要原因(A-G)填在相应的空格中(每格中只填一个字母)。
环境问题 产生原因
(1)酸雨_ _ A.空气中CO2浓度不断上升
(2)水土流失_ _ B.大量使用塑料包装袋和塑料农用地膜
(3)臭氧层被破坏_ _ C.工业上大量排放SO2
(4)温室效应_ _ D.大量使用农药和化肥
(5)白色污染_ _ E.生活污水大量排放,使藻类大量繁殖,水体严重缺氧
(6)土壤污染 _ _ F.乱砍滥伐森林
(7)水体“富营养化”_ _ _ G.大量使用氟利昂制品
三、推断题(本题共19分)
20、Ⅰ下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。(12分)(1)请在上表中用实线补全元素周期表边界。
| ③ | ④ | ⑤ | |||||||||||||||
| ① | |||||||||||||||||
| ② | |||||||||||||||||
(2)元素②与⑤形成的化合物的电子式为 。元素③氢化物的结构式为 。
元素①的单质、元素②的单质都和水反应,现象更为剧烈的是 。
元素④一般在化合物中显 价,但若能与 形成化合物,所显示的价态则恰好相反。(此题涉及到①②③④⑤时用对应的元素符号表示)
(3)元素A、B都是短周期元素,元素A与④同主族,元素A与B同周期,而且B的最外层电子数与电子层数相同,请在上方元素周期表中标明元素A、B的位置(用对应的元素符号表示)。
比较B原子半径与A原子半径: > (用对应的元素符号表示)。
比较A、B的最高价氧化物水化物的酸性强弱为: > (用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的 ,请写出元素在元素周期表中的位置与元素原子结构的关系: 。
*Ⅱ. (7分) 根据下图的实验现象,推断A、B、E、F、H各是什么物质。(填化学式)
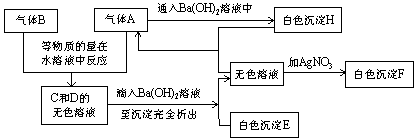
(1)A是________,B是________,E是________,F是________,H是________。
(2)A、B以等物质的量在水溶液中反应的离子方程式是:_____________________。
四、实验题(11分)
21、某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格:
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格:
①请写出铜跟浓硫酸反应的化学方程式:____________________________________。
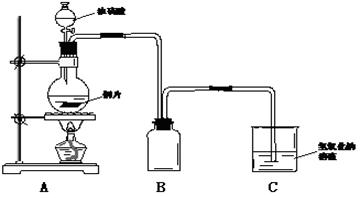 ②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:_____________________________________
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:_____________________________________
_________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_________ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,某学生进行了如下设计:
先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是____________________(填写字母编号,有几个写几个,多写或写错0分)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A中产生气体的体积(气体已折算成标准状况)
(4)如果(3)中测得标准状况下产生SO2的体积为1.792L,则被还原的硫酸的物质的量为 mol。
五、计算题(本题共8分)
22.(3分)把n molH2S在m molO2中充分燃烧,讨论下列情况下,n和m应满足的关系式:
(1)若只生成单质硫,则n:m应为_______;
(2)若只生成SO2,则n:m应为_______;
(3)若同时生成S和SO2,则n:m应为_______。
23、(5分)用18.4mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,所得SO42-离子浓度为3.18mol/L,
求(1)反应所得气体在标准状况下的体积, (2)溶液中CuSO4的物质的量浓度。
高一化学下复习迎考模拟试题2
![]() 第六章 氧族元素 环境保护
第六章 氧族元素 环境保护
高一化学答案
一、选择题(每小题只有一个正确答案,每小题3分,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| C | A | B | C | B | D | D | A | C | A | C | B | D | D | C | A |
Ⅱ卷 (非选择题:60分)
二、填空题(本题共27分)
17、(5分) (1) O3 、同素异形体
(2) 2H2O2 = 2 H2O + O2↑(用MnO2做催化剂)
(3) C+ 2H2SO4(浓)=CO2 ↑+ 2SO2↑+ 2H2O (条件:加热)
(4).(5分)I—被ClO—氧化为I2,I2遇淀粉变蓝色; ![]() ;I2被SO32—还原为I—;
;I2被SO32—还原为I—; ![]() ;
; ![]() (每空1分)
(每空1分)
18、(4分) (1) 113℃<熔点<452℃;(1分)
(2) – 2,+4,+6;(1分)
(3) H2S>H2Se>H2Te(1分)
(4) 还原性(1分)
19、(5分) H2SO3, ![]() ,H2SO3+Br2+H2O=H2SO4+2HBr,H2SO3+Ba(OH)2=BaSO3↓+2H2O,
,H2SO3+Br2+H2O=H2SO4+2HBr,H2SO3+Ba(OH)2=BaSO3↓+2H2O,
BaSO3+2HCl=BaCl2+SO2↑+H2O
20、(7分,各1分)(1) C (2) F (3) G (4) A (5) B (6) D (7) E
三、推断题(本题共19分)
21、Ⅰ(12分)(1)
| ③ | ④ | ⑤ | |||||||||||||||
| ① | Al | S | |||||||||||||||
| ② | |||||||||||||||||
(2)KF的电子式,NH3的结构式,K,负,F
(3)在元素周期表中填写Al、S的位置,Al>S,H2SO4> Al(OH)3
(4)周期性变化; 元素的周期数即为原子的电子层数,元素的主族序数即为原子结构的最外层电子数。
Ⅱ(7分).提示:以“无色溶液与![]() 反应生成白色沉淀F”为突破口,可知此溶液中含
反应生成白色沉淀F”为突破口,可知此溶液中含![]() ;
;
推知:A、B两气体必有一种含氯元素,又知等物质量在溶液中反应,可知为![]() 和
和![]() ;顺推可得答案。
;顺推可得答案。
(1)A:![]() ;B:
;B:![]() ;E:
;E:![]() ;F:
;F:![]() ;H:
;H:![]() 下列各组物质中化学键的类型相同的是
下列各组物质中化学键的类型相同的是
A. HCl MgCl2 NH4Cl B. H2O Na2O CO2
C. CaCl2 NaOH H2O D. NH3 H2O CO2
(2)![]()
四、实验题
22.(11分)(1) B装置中导气管长进短出(1分)
(2)①Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O (2分);
CuSO4 + SO2↑+ 2H2O (2分);
②反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应(2分);
③A、D(2分)(只写对一个给1分,写出2个给2分,多写或写错0分)
(3)①A、B、C(2分)(只写对一个给1分,写出2个或3个给2分,多写或写错0分)
(4) 0.08(2分)
五、计算题(本题共8分)
23.解析:H2S在O2中燃烧,O2量不同,所得产物不同,O2少量(即不足量)生成单质S,O2过量时生成SO2,故: ![]() ,
,
题中n molH2S在m molO2中燃烧,(1)若只生成单质硫,则n:m≥2:1;(2)若只生成二氧化硫,
则n:m≥2:3;(3)若同时生成硫和二氧化硫,则2:3<n:m<2:1。
24、 (1)解:根据方程式:Cu
+2H2SO4(浓) ![]() CuSO4 +SO2↑ +2 H2O
CuSO4 +SO2↑ +2 H2O
n(CuSO4 )=n(SO2)=18.4mol/L×0.02L—3.18mol/L×0.1L=0.05mol..
C(CuSO4 )=![]() =
=![]() =0.5mol/L.
=0.5mol/L.
(2) 1.12L