高一化学下学期月查试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Ag-108 Cl-35.5
第一卷(选择题 共48分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列图象中所发生的现象与电子的跃迁无关的是 ( )
 A
B
C
D
A
B
C
D
2.一个价电子构型为2s22p5的元素,下列有关它的描述正确的有:
A 原子序数为7
B 电负性最大
C 原子半径最大 D 第一电离能最大
3.最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含σ键又含π键的是
A.N2 B.CO2 C.CH4 D.H2O2
4.以下各分子中,所有原子都满足最外层为8电子结构的是 ( )
A. H3O+ B. BF3 C. CCl4 D. PCl5
5.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
6.下列各组分子中,都属于含极性键的非极性分子的是 ( )
A. CO2 、H2S B.BF3、CH4 C.C60、C2H4 D.NH3、HCl
7.下列事实中能证明氯化氢是共价化合物的是 ( )
A.液态氯化氢不导电 B.氯化氢极易溶于水
C.氯化氢不易分解 D.氯化氢溶液可以电离
8.最近研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是 C
A.羰基硫的电子式为![]() B.羰基硫属于非极性分子
B.羰基硫属于非极性分子
C.羰基硫中三个原子处于同一直线上 D.羰基硫沸点比CO![]() 低
低
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列各组无机酸的酸性强弱比较正确的是
A.HIO>HIO2>HIO3>HIO4 B. HClO4>HBrO4
C.HF<HCl<HBr<HI D. H2CO3<H2SiO3<H2GeO3
10. a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族。a的原子结构示意图:
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为![]() 。下列比较中正确的是
。下列比较中正确的是
A.原子半径:a>c>d>b B.电负性a>b>d>c
C.原子序数:d>a>c>b D.离子半径c3—>b+
11.下列物质不是配合物的是
A.NH4Cl B.Fe(SCN) 3
C.CuSO4•5H2O D.KAl(SO4)2•12H2O
12.X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是
A.X:3s23p1 Y:3s23p5 B.X:2s22p3 Y:2s22p4
C.X:3s23p1 Y:2s22p5 D.X:2s22p3 Y:1s1
13.8.已知磷酸分子 ![]() 中三个氢原子都可以跟重水(D2O)中D原子发生交换,次磷酸(H3PO2)也能跟D2O发生氢交换,次磷酸钠(NaH2PO2)却不能跟D2O发生交换,由此推断次磷酸的分子结构是
中三个氢原子都可以跟重水(D2O)中D原子发生交换,次磷酸(H3PO2)也能跟D2O发生氢交换,次磷酸钠(NaH2PO2)却不能跟D2O发生交换,由此推断次磷酸的分子结构是
A.![]() B.
B.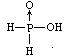 C.
C.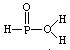 D.
D.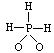
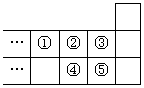 14.右图是元素周期表的一部分,下列说法中正确的是
14.右图是元素周期表的一部分,下列说法中正确的是
A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物酸性:⑤>④
D.元素的最高正化合价:③=⑤
第二卷(非选择题 共72分)
三、(本题包括1小题,共10分)
15.锌和铝都是活泼金属,其氢氧化物即能溶于强酸,又能溶于强碱,溶于强碱分别生成Na2[Zn(OH)4]和Na[Al(OH)4]。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
⑴[Al(OH)4]—、[Zn(OH)4]2—和[Zn(NH3)4]2+都是配离子,写出[Zn(NH3)4]2+的结构式▲ 。
⑵按要求写出下列反应的离子方程式:
①Al(OH)3溶于强碱溶液 ▲ ;
②Zn(OH)2溶于氨水 ▲ 。
⑶实验室若要制取少量Al(OH)3或Zn(OH)2,下列方法可行的是 ▲ 。
①向Al2(SO4)3溶液中加入足量NaOH溶液制取Al(OH)3
②向Al2(SO4)3溶液中加入足量稀氨水制取Al(OH)3
③向ZnSO4溶液中加入足量NaOH溶液制取Zn(OH)2
④向ZnSO4溶液中加入足量稀氨水制取Zn(OH)2
⑷若除去Al2(SO4)3溶液中的ZnSO4杂质,下列除杂方法正确的是 ▲ 。
①向溶液中加入足量的NaOH溶液,再过滤;
②向溶液中加入足量的氨水,再过滤;
四、(本题包括2小题,共18分)
16.A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行。己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B,B与C都能生成气态非极性分子的化合物;
③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1) 书写A、B、C、D的元素符号 ▲ 。
(2) C元素在周期表中的位置 ▲ ,原子结构示意图为 ▲ 。
(3) 用电子式表示D与E形成化合物的过程 ▲ ;
D与B形成的化合物的电子式 ▲ 。
(4)由以上元素组成的既含离子键又含极性键的化合物的电子式 ▲ 。
17.下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,
| A | B | ||||||||||||||||
| C | M | D | E | ||||||||||||||
| F | G | H | I | ||||||||||||||
| N | J | ||||||||||||||||
| K | L |
请回答下列问题:
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是 ▲ (填“元素符号”);按电子排布,可把元素划分成5个区,不全是金属元素的区为 ▲ 。
(2)下列叙述正确的是 ▲ (填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.A和E形成的化合物中只含极性键不可能含非极性键
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.C与G金属性质相似,单质或其氢氧化物既能与盐酸反应,又能与氢氧化钠溶液反应
(3)画出D的基态原子的原子轨道表示式 ▲ 。
(4)以上元素中, ▲ (填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)根据VSEPR理论预测DA4+离子的空间构型 ▲ ;ME2的空间构型 ▲ 。
(6)N的一种化合物CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 ▲ (填“极性”或“非极性”)分子。
五、(本题包括1小题,共10分)
18.1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
|
|
| O3的分子结构 |
(1)题中非极性键是 ▲ 键,特殊的化学键是 ▲ 键(填σ或π)
(2)选出下列分子与O3分子的结构最相似的的是 ▲ 。
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有 ▲ 对孤对电子。
(4)O3分子是否为极性分子 ▲ (填是或否)。
(5)O3与O2间的转化是否为氧化还原反应 ▲ (填是或否)。
六、(本题包括1小题,共12分)
19.有下列物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2 ⑨HCN
(1)只含极性键的是 ▲ ;既含极性键又含非极性键的是 ▲ ;
(2)只有σ键的是 ▲ ;既有σ键,又有π键的是 ▲ ;
(3)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是 ▲ ;
含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是 ▲ 。
七、(本题包括1小题,共10分)
20.图表法、图象法是常用的科学研究方法。
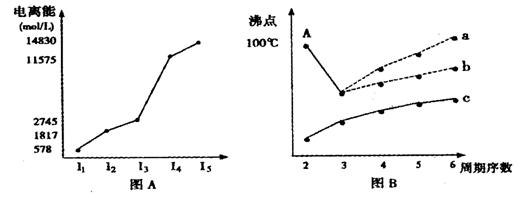
(1)短周期某主族元素M的逐级电离能如图(A)所示,则M元素位于周期表的第 ▲ 族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 ▲ 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是: ▲ ,理由是: ▲ 。
(3)下表列出了一些共价键的键长
| C—F | C—Cl | C—Br | C—I | C—C | C—Si | |
| 键长/pm | 98 | 161 | 182 | 204 | 154 | 170 |
则CF4、CCl4、CBr4、CI4四种物质中热稳定性最强的是 ▲ ,沸点最高的是 ▲ 。
八、(本题包括1小题,共12分)
21.(1)H—H的键能为436kJ/mol。它所表示的意义是形成1molH—H键所 ▲ (填“吸收”或“释放”)的最低能量为436kJ,反之如果要使1molH—H键断裂则 ▲ (填“吸收”或“释放”)能量。
(2)白磷P4(图1)是正四面体构型的分子,当与氧气作用时,每两个磷原子之间插入一个氧原子,此外每个磷原子又以双键再结合一个氧原子形成P4O10(图3)。如图:
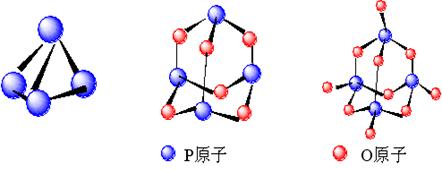
图1(P4) 图2(P4O6) 图3(P4O10)
化学反应本质是旧键断裂和新键的形成。
现提供以下化学键的键能(kJ/mol):P—P键:198 kJ/mol;P—O键:360 kJ/mol;
O=O键:498 kJ/mol;P=O键:585 kJ/mol;
试根据这些数据,通过计算,判断反应:P4+5O2=P4O10是吸热反应还是放热反应,吸收或者放出热量的值是多少?
参考答案
1、D 2、B 3、B 4、C 5、B 6、B 7、A 8、C
9、BC 10、D 11、AD 12、AD 13、B 14、C
15、(1)可表示为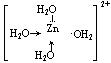
(2)①Al(OH)3+ OH—=[Al(OH)4]—
②Zn(OH)2+4 NH3·H2O =[Zn(NH3)4]2++2OH—+4H2O
(3)② (4)②
![]() 16.(1)H、C、O、F
16.(1)H、C、O、F
![]() (2)第二周期 ⅥA;
(2)第二周期 ⅥA;
(3)(4)略。
17、(1)He、Be、Fe ;S区、P区 (2)a、d、f
(3) (4)He (5)正四面体;直线型(6)非极性
18、(1)σ,π (2)C (3)5 (4)是 (5)否
19、(1)①③⑨; ⑤⑥⑧;(2)①②③⑥⑦⑧;④⑤⑨;(3)①;②④
20、(1)ⅢA (2)ⅣA; b,其它氢化物的沸点不可能超过水的沸点。
(3)CF4、、CI4
21、(1)释放、吸收
(2)放热反应,放出2982KJ的热量
UploadSoft/20083/SMEZ.rar
