高一化学下学期期中模拟试卷
化学试卷
1.考试时间:90分钟 满分:100分
2.相对原子质量:H 1 C 12 O 16 Na 23 Al 27 S 32 Cl 35.5 Fe 56
第Ⅰ卷 (选择题)
选择题(共18小题,每小题只有1个正确答案,每小题3分,共54分)
1.Se是人体必需微量元素,下列关于![]() 和
和![]() 的说法正确的是( )
的说法正确的是( )
A.![]() 和
和![]() 互为同素异形体 B.
互为同素异形体 B.![]() 和
和![]() 都含有34个质子和中子C.
都含有34个质子和中子C.![]() 和
和![]() 分别含有44和46个质子 D.
分别含有44和46个质子 D.![]() 和
和![]() 互为同位素
互为同位素
2.一种比黄金贵百倍的18O2气体,不久前在兰州近代物理研究所制备成功。1mol 18O2气体中所含中子的物质的量为( )
A.16mol B.18mol C.20mol D.24mol
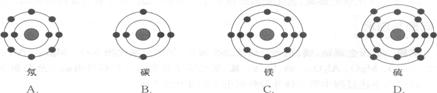
![]() 3.已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为 下列原子中,与氧元素原子的化学性质相似的是 ( )
3.已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为 下列原子中,与氧元素原子的化学性质相似的是 ( )
4.现有xMm- 和yNn+ 两种简单离子,它们的电子层结构相同。则表示M元素质子数的正确表达式是:( )
A.x=y+n+m B.x=y-n-m C.x=y+n-m D.x=y-n+m
5.A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为( )
A.n+8 B.n+18 C.n+32 D.n+20
6.已知碳有三种核素 12C、13C、14C,氧元素也有三种核素 16O、17O、18O,则由以上核素形成的不同CO2分子的分子量有( )
A. 10种 B. 8种 C. 9种 D. 7种
7.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a, c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、e、d、c B.e、d、a、b、c
C.a、b、d、c、e D.c、d、e、a、b
8.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、
W四种元素的描述,不正确的是( )
A.原子半径:X>Y>Z>W B.原子序数:Y>X>Z>W
C.原子最外层电子数:Z>W>Y>X D.还原性:X>Y,W2->Z-
9.已知下列元素的原子半径为
| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是( )
A. 0.80×10-10m B. 1.10×10-10m
C. 1.20×10-10m D. 0.70×10-10m
10.下列说法正确的是( )
A、含有共价键的化合物可能是共价化合物
B、在共价化合物中可能存在离子键
C、含有离子键的化合物中一定是没有共价键
D、难失电子的原子,获得电子的能力一定强
11.已知SO2和O2反应生成4mol SO3时放出的热量为Q kJ,那么2mol SO2和
1mol O2在一有催化剂的密闭容器中发生反应时,放出的热量为( )
A.大于Q kJ B.等于Q kJ C.小于0.5Q kJ D.无法确定
12.铜片和锌片用导线连接后插入稀硫酸中,电解质溶液的pH( )
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
13.人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为:
Zn + 2OH- - 2e- = ZnO + H2↑,Ag2O + H2O + 2e- = 2Ag+ 2OH-。据此判断
氧化银是( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
14. 等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在C的生成物中,该金属元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
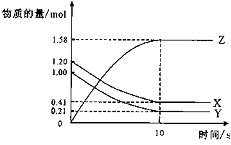 15. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
15. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
下列描述正确的是( )
A、反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B、反应开始到10s,X的物质的量浓度减少了0.79mol/L
C、反应开始到10s时,Y的转化率为79.0%
D、反应的化学方程式为:X(g)+ Y(g)![]() Z(g)
Z(g)
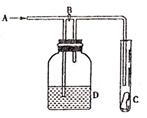 16.如图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
16.如图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
A.浓H2SO4
B.饱和NaCl溶液
C.浓NaOH溶液
D.浓KI溶液
17.取一定量的甲烷与少量氧气混合点燃,生成CO、CO2和水蒸气的混合物49.6g,将燃烧混合物缓缓通过无水氯化钙并吸收完全,氯化钙的质量增加25.2g,由此可知甲烷不完全燃烧所得产物中碳的氧化物的总质量是( )
![]() A.11.2g B.28g C. 13.2g D.24.4g
A.11.2g B.28g C. 13.2g D.24.4g
18.烃分子可以看作由以下基团组合而成:
如某烷烃分子中同时存在这四种基团,则该烷烃最少含有的碳原子数应是( )
A.6 B.7 C.8 D.10
第II卷 (非选择题 46分)
![]()
19.(4分)某简单微粒的结构示意图为:且X、Y 均为不大于20的正整数,据此回答下列问题:
(1)若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是
(2)若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为
(3)若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x= y= 。
20.(6分)A、B、C均为短周期元素,在周期表中的位置如图所示:
| A | C | ||
| B | |||
回答下列问题:
(1)A、B、C的元素符号为: 、 、 ;
(2)C的单质和水反应的化学方程式为: ;
B的最高价氧化物的水化物的化学式为: ;A的氢化物的水溶液
呈 (酸性或碱性)。
21.(10分 )
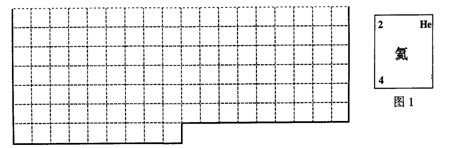 |
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
 (2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(3)元素乙的M层上有3个电子,则乙原子半径与甲原子半径比较:________>________(用元素符号表示),甲、乙的最高价氧化物水化物相互反应的离子方程式为:
(4)元素周期表体现了元素周期律,即元素的性质随着 _________的递增呈现 _ ____的变化。
22.(11分)某研究小组为制备消毒液(主要成分是NaClO)设计了下列装置 ,并查阅下列资料:在温度较高情况下卤素单质和碱溶液能发生如下反应:
![]()
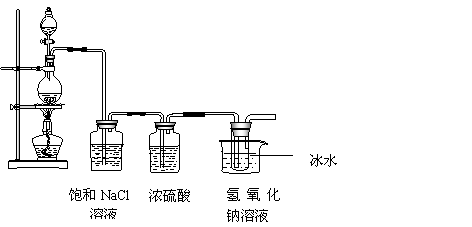 3X2+6OH- 5X-+XO3-+3H2O
3X2+6OH- 5X-+XO3-+3H2O
回答下列问题:
(1)仪器 A的名称为 发生装置中反应的离子方程式为:
。
(2) 饱和NaCl溶液的作用是 ,能否省去盛有浓硫酸的洗气瓶? ,理由是 .
(3)能否省去冰水冷却? ,用化学方程式表示原因是:
,大试管内发生反应的离子方程式为 。
|
|
| 改变条件 | 速率变化 | ||
| 降低温度 |
| ||
| 增在O2的浓度 | |||
| 使用V2O5做催化剂 | |||
| 压缩气体 |
(2)(5分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
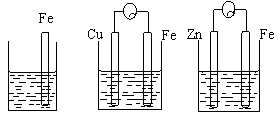
|
|
|
①A中反应的离子方程式为 ,B中Cu极电极反应式为 。
②C中被腐蚀的金属是 ,总反应方程式为 ,
③A.B、C中铁被腐蚀的速率,由大到小的顺序是 。
24.(6分)150℃、101.3kPa时,1.5L某烃CXHY蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L (同温同压下测定)。
(1)该烃在组成上必须满足的条件是
(2)当a = 10L时,该烃可能的分子式为
(3)当该烃的分子式为C7H8时,a的取值范围为 。
答题纸
班级: 姓名:
选择题:(每小题3分,共54分)得分:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 题号 |
第II卷 (非选择题 46分)
19.(4分)
(1)
(2)
(3) x= y= 。
20.(6分)
(1) 、 、 ;
(2) ;
; (酸性或碱性)。
21.(10分 )
 |
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
 (2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(3) ________>________(用元素符号表示),
(4) _________, _ ____。
22、(11分)
(1) , 。
(2) , , 。
(3) , , 。
23.(1)(4分)
将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增在O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
(2)(5分)
① , 。
② , ,
。
24.(6分)得分:
(1)
(2)
(3) 。
高一化学模拟试题答案
一、选择题
1.D 2.C 3.D 4.B 5.D 6.D 7.A 8.A 9.B 10.A 11.C 12.C 13.B
 14.A 15.C 16.B 17.D 18.C
14.A 15.C 16.B 17.D 18.C
二、非选择题
19.(1)Ar (2) (3)19 8 (每空1分 )
20.(1)N S F (2)2F2+2H2O=4HF+O2
(3)H2SO4 碱性 (每空1分)
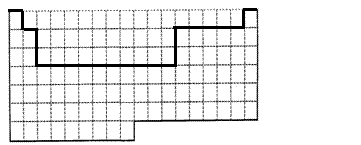 21.(共10分)
21.(共10分)
(1)
|
(4)原子序数 周期性
22.(1)分液漏斗 MnO2+4H++2Cl-Mn2++2H2O+Cl2↑ (2分)
(2)除去氯气中的氯化氢 能 水的存在不影响氯气和氢氧化钠的反应
(3)不能 3Cl2+6NaOH5NaCl+NaClO3+3H2O (2分)
Cl2+2OH-=Cl-+ClO-+H2O (2分) (其它每空1分)
23.(1)B A A A (每空1分)
(2)① Fe+2H+=Fe2++H2 2H++2e-=H2
②Zn Zn-2e-=Zn2+ ③B>A>C (每空1分)
24.(1)该烃的一个分子中氢原子数必须为8(或y=8)
(2)C3H8 C4H8 (3)a≥13.5(每空2分共6分)