高一化学下学期模块水平测试(必修2)
(试卷满分:100分;考试时间:90分钟)
第I卷(选择题,共44分)
友情提示:
1、第Ⅰ卷共4页。答第Ⅰ卷前,考生务必将自己的姓名、准考证号填写在第5页密封线内的相应空格中。
2、选择题选出答案后,把答案的序号填写在第5页的选择题答题表中。
相对原子质量:H:1 C:12 O:16 Na:23 Al:27 S:32
Cl:35.5 K:39 Mn:55
一、选择题(本题共有22小题,每小题2分,共44分。每小题只有一个选项符合题意。)
1.下列物质中,属于天然高分子化合物的是
A.油脂 B.纤维素 C.氨基酸 D.聚氯乙烯
2.下列过程中,需要增大化学反应速率的是
A.钢铁腐蚀 B.食物腐败 C.塑料老化 D.工业合成氨
3.一次性餐具目前最有发展前景的是
A.瓷器餐具 B.淀粉餐具 C.塑料餐具 D.纸木餐具
4.下列各项中表达正确的是
![]()
![]() A.F - 的结构示意图:
B.乙炔分子比例模型:
A.F - 的结构示意图:
B.乙炔分子比例模型:
![]()
![]() C.NaCl的电子式:
D.N2的电子式:
C.NaCl的电子式:
D.N2的电子式:
5.下列物质中加入金属钠不产生氢气的是
A.乙醇 B.乙酸 C.水 D.苯
6.在元素周期表中金属和非金属的分界线附近的一些元素能用于制
A.合金 B.半导体 C.催化剂 D.农药
7.根据硅在元素周期表中的位置,硅的最高价含氧酸的化学式不可能是
A.H2SiO3 B.HSiO3 C.H4SiO4 D.H6Si2O7
8.下列物质中,不含共价键的是
A.NaCl B.Cl2 C.HCl D.NaOH
9.Cl与Cl-两种粒子中,相同的是
A、化学性质 B、核外电子数
C、最外层电子数 D、核外电子层数
10.A、B两种元素能形成AB2型化合物,则A和B的原子序数可能是
A.11和8 B.12和17 C.11和16 D. 8和12
11.下列物质中可用来鉴别乙酸、乙醇、苯的是
A、金属钠 B、溴水 C、碳酸钠溶液 D、酸性高锰酸钾溶液
12.下列关于“生活中的化学”的叙述中错误的是
A.棉花和蚕丝的主要成分都是纤维素
B.误食重金属盐,可立即喝牛奶或生蛋清进行解毒
C.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,它是人体的营养物质
D.新居室内装饰材料中缓慢释放出的甲醛等有机物会污染室内空气
13.在下列有关晶体的叙述中错误的是
A.离子晶体中,只含离子键 B.原子晶体中,只存在共价键
C. 分子晶体中,不含共价键 D.稀有气体的原子能形成分子晶体
14.下列各组顺序的排列不正确的是
A.原子半径:Na<Mg<Al B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H4SiO4<H2CO3<CH3COOH D.熔点:金刚石>食盐>干冰
15.X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是
A.X>Y>Z B.Z>Y>X C.X>Z>Y D.Y>X>Z
16.下列措施对增大反应速率明显有效的是
A.Al在氧气中燃烧生成A12O3,将Al粉改为Al片
B.Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸
C.Zn与稀硫酸反应时,适当提高溶液的温度
D.Na与水反应时增大水的用量
17.某有机物分子中碳、氢的质量分数分别是40%、6.6%,其余为氧。A的溶液能使紫色石试液变红色,则A是
A.HCHO B.CH3CH2CH2OH C.CH3COOH D.CH3CH2COOH
18.某有机物在氧气中完全燃烧,生成水蒸气和二氧化碳的物质的量之比为1∶1,由此可以得出的结论是
A.该有机物分子中的C、H、O的个数比为1∶2∶3
B.分子C、H原子个数比为2∶1
C.该有机物中必定含O
D.该有机物中必含有C、H,无法判断是否含有O
19.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是
A.含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:Z>Y>X
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.下列反应可以发生:X2 + Y2- = 2X- + Y
20.绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中(反应均在一定条件下进行),原子经济性最好的是
![]()
![]()
![]()
![]() A. +C2H5Cl
C2H5 + HCl
A. +C2H5Cl
C2H5 + HCl
![]()
![]()
![]()
![]() B. +C2H5OH
C2H5 + H2O
B. +C2H5OH
C2H5 + H2O
![]()
![]()
![]()
![]() C. +CH2=CH2
C2H5
C. +CH2=CH2
C2H5
![]()
![]()
![]()
![]()
![]() D.
CHBr-CH3
CH = CH2+HBr
D.
CHBr-CH3
CH = CH2+HBr
![]()
![]()
![]()
![]() CH =CH2+H2
C2H5
CH =CH2+H2
C2H5
21.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);
△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-893kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最多的是
A、H2(g)
B、CO(g)
C、C8H18(l)
D、CH4(g)
![]() 22.将N2和H2置于2L密闭容器中,反应2min后,生成0.8molNH3。在这段时间内,用N2浓度变化表示的反应速率为
22.将N2和H2置于2L密闭容器中,反应2min后,生成0.8molNH3。在这段时间内,用N2浓度变化表示的反应速率为
A、0.05mol·L-1·min-1 B、0.1mol·L-1·min-1
C、0.2mol·L-1·min-1 D、0.4mol·L-1·min-1
化 学(必修2)试 卷
(试卷满分:100分;考试时间:90分钟)
登分表:
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
选择题答题表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
第Ⅱ卷(非选择题 共56分)
二.填空题(5小题,共40分)
23.(8分)
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g) ===2H2O(l)ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量
 (填“>”、“<”或“=”)572 kJ
(填“>”、“<”或“=”)572 kJ
(2)与化石燃料相比,利用氢能源很多优点,请说出其中一点
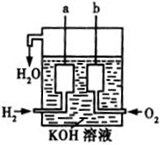
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:a、b两个电极均由多孔的碳块组成。它是将 能转化为 能的装置。
24.(6分)
将下列物质进行分类:①11H 与 13H ② O2 与O3 ③乙醇与甲醚(CH3-O-CH3)
④ H2O 与 D2O ⑤ CH3CH2CH2CH3 与CH3-CH(CH3)-CH3 ⑥ C60 与C70
⑴ 互为同位素的是 (填编号,下同);
⑵ 互为同素异形体的是
⑶ 互为同分异构体的是
25.(10分)
下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
⑴ 在①~⑧元素中化学性质最不活泼的元素的符号是 金属性性最强的是
⑵ ①、②、③、⑤、⑦五种元素中的原子半径最小的是 (填元素符号)
⑶ ①、②、③三种元素形成的离子,离子半径由大到小的顺序是 (用离子符号填写)
⑷ ①、③、⑤、⑦四种元素最高价氧化物对应的水化物中,碱性最强的是
酸性最强的是 (填化学式)
⑸ ④与⑥形成的化合物的电子式为
 26、(5分)有A、B、C、D四种元素的原子序数依次增大,B的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的原子结构示意图为:
; , D的最外层电子数是电子层数的2倍。试回答下列各问题:
26、(5分)有A、B、C、D四种元素的原子序数依次增大,B的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的原子结构示意图为:
; , D的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)A原子的阴离子的结构示意图为 。
(2)C元素位于元素周期表中第 周期、第 族;
(3)化合物B2A分子的电子式为
;
(4)D的最高价氧化物的水化物的分子式是 。
27.(10分)
通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品。试根据下图回答有关问题:
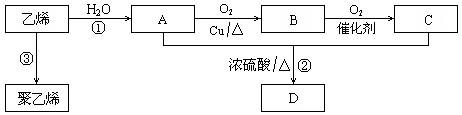 |
⑴ 有机物 B 的名称为 ,结构简式为 。决定有机物 A、 C 的化学特性的原子团的名称分别是 。
⑵ 写出图示反应①、③的化学方程式,并指明反应类型:
① ;反应类型:
③ ;反应类型:
三、实验题(2小题,共12分)
28、(4分)小明同学做同周期元素性质递变规律的实验,自己设计了一套实验方案,请你帮他完成下面的实验报告
| 实验步骤 | 实验现象 | 结论 |
| (1)将镁条和铝条用砂纸打磨后,分别放入沸水中,并滴加酚酞 | 镁的金属性比铝活泼 | |
| (2)向新制的得的Na2S溶液中滴加氯水 | 有淡黄色沉淀生成 |
29.(8分)
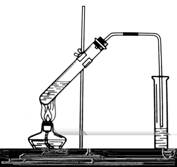 如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。(实验图我会重新制作)
如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。(实验图我会重新制作)
⑴ 写出左试管中主要反应的方程式:
;
⑵饱和Na2CO3的作用是:__________________________________________ ;
⑶实验生成的乙酸乙酯,其密度比水 ,有 气味,把它从右试管的混合物中分离出来的操作是 (填操作名称),所需要的主要仪器是 。
四、计算题(6分)
30.燃烧法是测定有机化合物化学式的一种重要方法。现在完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸和浓氢氧化钠溶液,实验结束后,称得浓硫酸增重10.8g,浓氢氧化钠溶液增重22 g。求:
⑴ 该烃的分子式;
⑵ 若完全燃烧0.1mol该烃生成CO2气体和液态水,放出150kJ的热量,写出反应的热化学方程式;计算完全燃烧144g该烃生成CO2气体和液态水时放出的热量。
化学参考答案
第Ⅰ卷(选择题,共44分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共44分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 选 项 | B | D | B | A | D | B | B | A | D | B | C |
| 题 号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 选 项 | A | C | A | A | C | C | D | D | C | A | C |
第Ⅱ卷(非选择题,共56分)还没改
二、填空题(5小题,共40分)
23.(8分)
(1)小于 (2分)
(2)小于 (2分)
(3)氢气完全燃烧放出的热量比等质量的化石燃料放出的热量多;原料是水,资源不受限制,燃烧产物是水,不会污染环境。 (其它合理答案也给分,2分)
(4)化学能;电能 (2分)
24.(6分)
⑴ ① (2分。多选或选错本题不得分)
⑵ ②⑥ (各1分,共2分。只要选错一个,本题不得分)
⑶ ③⑤ (各1分,共2分。只要选错一个,本题不得分)
25.(9分)
⑴ Ar;Na (各1分,共2分)
⑵ NaOH;HClO4 (各1分,共2分)
⑶ Cl (1分)
⑷ Na+、Mg2+、Al3+ (2分)
⑸![]() (2分)
(2分)
26、(5分)
![]() (1) (2)4;ⅣA
(1) (2)4;ⅣA
![]() (3) (4)H2SO4 (每空1分,共5分)
(3) (4)H2SO4 (每空1分,共5分)
27.(10分)
⑴ 乙醛;CH3CHO;羟基、羧基 (各1分,共4分)
![]() ⑵
① CH2=CH2 + H2O
CH3CH2OH(2分);加成反应 (1分)
⑵
① CH2=CH2 + H2O
CH3CH2OH(2分);加成反应 (1分)
![]()
![]() ③ n CH2=CH2
(2分);加聚(或聚合)反应 (1分)
③ n CH2=CH2
(2分);加聚(或聚合)反应 (1分)
三、实验题(2小题,共12分)
28.(4分)
(1)放镁条的试管冒出无色气泡快,滴入酚酞时,溶液的红色更深 (2分)
(2)氯的非金属性比硫的非金属性强 (2分)
29.(8分)
![]() ⑴ CH3COOH + C2H5OH
CH3COOC2H5 + H2O (2分)
⑴ CH3COOH + C2H5OH
CH3COOC2H5 + H2O (2分)
⑵除去乙酸和乙醇,并促使乙酸乙酯分层析出 (2分)
⑶小;芳香;分液;分液漏斗 (各1分,共4分)
四、计算题(本题6分)
30.(6分)
⑴ C5H12 (2分)
⑵ C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(l);△H=-1500KJ/mol (2分)
3000KJ (2分)