高一年级化学第一学期期中考试试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试时间100分钟。
第Ⅰ卷(选择题 共62分,请将答案填涂在答题卡上)
相对原子质量:Zn:65 Fe:56 Mg:24 Al:27 Cu:64 K:39
Na:23 C:12 O:16 H:1 S:32
一、单项选择题(本题包括10小题,每小题3分,共30分。每小题只有一个正确选项)
1、在自然界中,既有以化合态存在,又有以游离态存在的元素是
A、碳 B、硅 C、镁 D、铝
2、下列物质中,既能与盐酸反应又能与NaOH溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤(NH4)2CO3 ⑥Al
A.②③ B.②③⑥ C.①②③⑤⑥ D.全部
3、能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀
4、小华家中有如下生活用品:碘酒、食盐、食醋、84消毒液(内含NaClO),小华利用上述用品不能完成的任务是
A.检验买来的奶粉中是否加有淀粉 B.检验自来水中是否含有Cl-
C.除去保温瓶中的水垢 D.洗去白色衣服上的番茄汁
5、下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:Fe3+ + Fe == 2Fe2+
D.二氧化碳通入“水玻璃”中:CO2 + SiO32― + 2H2O == CO32―+ H4SiO4↓
6、下列物质中,不属于合金的是
A. 硬铝 B.黄铜 C. 钢铁 D.金箔
7、只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液, 这种试剂是
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
8、光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的
A.碳 B.石英 C.锗 D.硅
9、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为 A
A.1:1 B.2:3 C.3:2 D.1:6
10、蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个正确选项。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11、某种具有净水作用的无机高分子混凝剂的化学式可以表示为 [Al2(OH)nClm·yH2O]x ,式中的m等于
A、3-n B、6-n C、n+6 D 、n+3
12、熔融烧碱样品应使用下列器皿
A.石英坩埚 B.普通玻璃坩埚 C.生铁坩埚 D.瓷坩埚
13、把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为
A.1︰1 B.2︰5 C.4︰1 D.3︰1
14、已知常温下在溶液中可发生如下两个离子反应:Ce4+ + Fe2+ = Fe3++ Ce3+ ,Sn2+ + 2Fe3+ =2 Fe2++ Sn4+ 。由此可以确定Fe2+、Ce3+、Sn2+ 三种离子的还原性由强到弱的顺序是
A.Sn2+ 、Fe2+、Ce3+ B.Sn2+ 、Ce3+ 、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+ 、Ce3+
15、下列叙述中正确的是
A、含金属元素的离子,不一定都是阳离子
B、在氧化还原反应中,非金属单质一定是氧化剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
16、下列各组离子中可能在某无色溶液中大量共存的是AB
A.MnO4-、K+、Na+、SO42- B.K+, H+, CO32-, Cl-
C.Mg2+、NH4+、Cl-、NO3- D.Ba2+、K+、HCO3-、Cl-
17、由Zn、Fe、Al、Mg四种金属中的两种组成的混合物13g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物可能的组成是 C
A.Zn和Fe B.Fe和Al C. Al和Mg D.Mg和Fe
18、将5.6LCO2气体缓慢通过一定量的Na2O2固体后,得到3.36L气体(气体体积均在标准状况下测定),所得气体的质量为
A.3.8g B.4.8g C.5.4g D.6.6g
第Ⅱ卷(非选择题 共58分 请将答案写在答卷纸上)
三、(本题包括2小题,共20分。)
19、(8分)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应: KIO3+ KI+ H2SO4=== K2SO4+ I2+ H2O
(1) 将上面氧化还原反应的化学方程式配平
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为_________________。
(4)利用上述反应检验食盐中是否加碘,所需试剂是________________(填下列选项的序号)
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液
20、(12分)氧化还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是 。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有 。 (填“氧化性”或“还原性”);
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
如果药片已经失效,应如何检验?写出主要操作与现象: 。
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式 。
四、(本题包括2小题,共16分。)
21、(8分)胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,受热可缓缓分解;②能溶于水,水溶液呈弱碱性;灼烧时火焰为黄色;③遇酸及酸性药物则产生二氧化碳;④患者服用过量,可能引起胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸是中和作用缓慢而持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用;③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
(3)三硅酸镁Mg2Si3O8·nH2O也是常用胃药,被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸作用持久。把三硅酸镁改写成氧化物形式为:_____ ____。
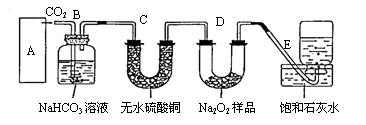 22. (8分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和一定量过氧化钠样品为原料,制取O2, 设计出如下实验装置:
22. (8分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和一定量过氧化钠样品为原料,制取O2, 设计出如下实验装置:
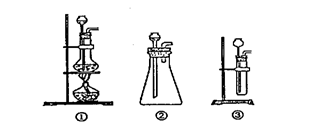
(1)A是制取CO2 的装置,
应从下列图①、②、③中最好选哪个图:
(2)B装置的作用是吸收A装置中产生的盐酸酸雾,C装置的作用是 。C装置内可能出现什么现象? 。
(3)在取出集气瓶后,如何检验E中收集到的气体 。
五、(本题包括1小题,共12分。)
23.(12分)有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
|
|

|
白色沉淀
![]()
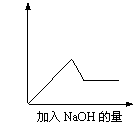 第③个实验中,生成白色沉淀的量与加入NaOH的量有右图
第③个实验中,生成白色沉淀的量与加入NaOH的量有右图
所示的相互关系。据此可知:
⑴在原溶液中一定不存在的离子有_____________________,
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
____________________
。
六、计算题(本题包括1小题,共10分,题目见答卷纸)
高一年级期末考试试卷化学 答卷纸
第Ⅰ卷(选择题 共62分,请将答案填涂在答题卡上)
第Ⅱ卷(非选择题 共58分 请将答案写在答卷纸上)
三、(本题包括2小题,共20分。)
19、(8分) (1) 配平 KIO3+ KI+ H2SO4=== K2SO4+ I2+ H2O
(2) 。
(3)_________________。
(4) _____________________。
20、(12分)
(1)_________________。 (2)_________________。
(3) 。
(4) 。
。
(5) 。
四、(本题包括2小题,共16分。)
21、(8分)(1) ;
(2) 。
(3)_____ ____。
22、(8分)(1) ___________________________。
(2)________________________________,___________________________________。
(3)_________________________________________________________________________。
五、(本题包括1小题,共12分。)
23.(12分) ⑴____________________________________。
⑵________________________和______________________。
⑶____________________
___ ___ _____ ___ ___ __________ 。
六、(本题包括1小题,共10分)
24.(10分)向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)(4分)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)(6分)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的?其质量各为多少?所用的KOH溶液的物质的量浓度为多少
参考答案
1、A 2、C 3、B 4、B 5、D 6、D 7、C 8、B 9、A 10、B
11、B 12、C 13、B 14、A 15、 AD 16、CD 17、BD 18、C
19、(1)1,5,3,3,3,3 (2)1:5 (3)0.12mol
(4)②③④
20、⑴ C6H12O6 ⑵还原性
(3)还原作用
(4) 保护FeSO4不被空气中的氧气氧化;取少量研碎的药片放入烧杯中,加适量的水溶解,然后滴加数滴KSCN溶液,反应后溶液显红色,则表明该药片已部分或全部失效。
(5) 2Fe3++ Cu=2Fe2++ Cu2+。
21、(1) NaHCO3 ; Al(OH)3 。
(2) HCO3-+H+==H2O+CO2 ↑ 。
(3)2MgO·3SiO2·nH2O。
22、(1)②;
(2)吸收水蒸气,使只有一种物质CO2和过氧化钠反应;白色固体变蓝色;
(3)用带火星的木条伸在集气瓶口,木条能复燃。
3.(12分)(1)Fe3+、Fe2+、Cu2+、NH4+、CO32-;
(2)KAl(SO4)2(或KAl(SO4)2·12H2O) MgSO4
(3)Mg2++2OH-=Mg(OH)2↓
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
(如写两个,其中一个是Al3++4OH-=AlO2-+2H2O酌情扣分)
24.(1)①K2CO3+KOH ②K2CO3 ③K2CO3+KHCO3 ④KHCO3
(2)K2CO3 质量为:6.9g,KHCO3质量为:5.0g
KOH 溶液物质的量浓度为:0.5mol•L—1