高一化学上册期中考试题试卷
可能用到的相对原子质量:N——14 O——16 C——12 S——16
Na——23 Fe——56 Al——27 Li——7
一、选择题:(每小题2分共20个小题40分)
1、下列说法正确的是( )
A、一氧化碳的摩尔质量是28克
B、 B、氧原子的质量就是氧原子的相对原子质量。
C、1molN2的质量在以克为单位时,数值上等于它的相对分子质量。
D、1摩尔二氧化碳含有的分子的准确数目是6.02×1023个
2.、用1L1.0mol/L的NaOH溶液吸收0.8molCO2,所得溶液中CO32-与HCO—物质的量之比为( )
A、1:3 B、2:1 C、2:3 D、3:2
3、将Na2O2投入FeCl3溶液中,观察到的实验现象是( )
A、有白色沉淀生成 B、有红褐色沉淀生成同时有无色气体生成
C、没有沉淀生成 D、生成银白色固体
4、下列各离子组可在同一溶液中大量共存,且形成无色溶液的是( )
A.K+、Na+、OH-、NO3- B.Cu2+、Ba2+、Cl-、NO3-
C.Na+、Mg2+、OH-、SO42- D.Ca2+、H+、NO3-、CO32-
5、O2、SO2、SO3三者的质量之比为2:4:5时,它们的物质的量之比为( )
A.2:5:5 B、1:2:3 C 1:1:1 D 2:2:3
6、下列离子方程式正确的是( )
A.石灰石和盐酸反应 CO32-+2H+=CO2 + H2O
B.钠和水反应 Na+2H2O=Na++2OH-+H2
C.烧碱溶液中通入过量CO2 CO2+OH-=HCO3-
D.碳酸氢钠与氢氧化钠 HCO3-+ OH-= H2O+CO2
7、设NA代表阿伏加德罗常数,下列0.2mol/L硝酸钡溶液的说法不正确的是( )
A.1L溶液中阴阳离子总数是0.6NA
B.1L溶液中含有0.2NA个NO3-离子
C.500mL 溶液中Ba2+离子浓度是0.2mol/L
D.500mL 溶液中含NO3-离子浓度是0.4mol/L
8、同质量的Na、Al、Fe分别与足量同体积同浓度的盐酸反应,放出的H2在相同条件下的体积关系是( )
A.VNa>VAl>VFe B.VFe >VAl >VNa
C.VAl>VFe>VNa D.VAl> VNa>VFe
9、在一个密闭容器中盛有11gX气体(X的摩尔质量为44g/mol)时,压强为1×104Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数约为 ( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
10、物质的量相同的任何气体物质,相同的是( )
A、体积 B、质量 C、摩尔质量 D、分子数
11、某碱金属0.195克与足量水反应,生成0.005克氢气,则此金属为( )
A Li B Na C K D Rb
12 、.实验室称取固体NaOH,应将其放在天平上的( )
A.滤纸上 B.坩埚中 C小烧杯中 D.托盘上
13、下列情况中含微粒数目最多的是( )
A、1molH2中的H原子 B、0.5molOH—中的电子
C、0.6molH2SO4中的O原子 D、1molNa完全反应后失去的电子。
14、.2Na2O2+2CO2=2Na2CO3+O2反应中,电子转移数目( )
A.1e- B.2e- C.3e- D.4e-
15、NA代表阿伏加德罗常数,下列说法正确的是( )
A、2.3克金属钠变为钠离子失去的电子数目为0.1NA
B、18克水所含有的电子数目为NA
C、在常温常压下,11.2L氯气所含的原子数目为NA
D、2.8克氮气和一氧化碳混合气体的 原 子数目为2NA
16.根据阿伏加德罗定律,下列叙述中正确的是( )
A.同温同压下,两种气体的体积之比等于摩尔质量之比
B.同温同压下,两种气体的物质的量之比等于密度之比
C.同温同压下,两种气体的摩尔质量之比等于密度之比
D.同温同压下,两种气体的物质的量之比等于压强之比
17、某CO和CO2的混合气体平均分子量为32,则混合气体中CO和CO2的体积比是( )
A、1∶3 B、3∶7 C、1∶2 D、3∶1
18.相同质量的下列物质充分加热后,产生的气体最多的是( )
A. Na2CO3 B. Ca(HCO3)2 C .NaHCO3 D. KHC O3
19、m g某物质A中含有n个分子,则A物质的摩尔质量的数值为(NA表示阿佛加德罗常( )
A、mn/NA B、mNA /n C、nNA/m D、mnNA
20、无线电工业常用FeCl3来腐蚀铜板,制作印刷线路。发生的反应
是:2FeCl3 + Cu == 2FeCl2 + CuCl2, 对于此反应,说法正确的是( )
(A)Cu能与Fe3+反应,说明Cu比Fe活泼
(B)氧化性Cu2+ > Fe2+,在反应中Cu作氧化剂
(C)氧化性Fe3+ > Cu2+,在反应中FeCl3作氧化剂
(D)此反应是氧化—还原反应,FeCl2是氧化产物
请将选择题的答案写在下列表格中(考试结束后只交本页)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
二填空题(每个空2分共40分)
21、填表:
| 实验操作 | 实验现象 | 离子反应方程式 |
| 一小块钠投入FeCl3 溶液中 | ||
| 碳酸钠与醋酸溶液 混合 | ||
| 盐酸加入KHCO3 溶液中 |
1、1.6克某物质含有3.01×1022个分子,则该物质的相对分子质量为____________,摩尔质量为______。
2.、物质的量为1mol的12C中含有_________个12C,它们的质量是_________kg,含有同数目的氧气分子的物质的量是________mol,质量是___________kg。
3.212克Na2CO3溶于水可电离出________mol Na+,_____molCO32-,将这些CO32-完全沉淀,需要____molCaCl2,最多可制取____mol气体。
4、下列物质中,物质的量最大的是___________,含分子个数最多的是______,含原子个最多的是__________,质量最大的是__________。(均填字母)
A、6克H2 B、0.5摩尔CO2 C、92克C2H5OH D、148克H2SO4
E、 1.2×1024个HCl分子 F、4℃时10ml水
三、实验题
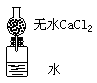 23、(6分)为了测定某种碱金属的相对原子质量而设计的装置如图。该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中,立即塞紧瓶塞。完全反应后再称量此装置的质量为cg。则:
23、(6分)为了测定某种碱金属的相对原子质量而设计的装置如图。该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中,立即塞紧瓶塞。完全反应后再称量此装置的质量为cg。则:
⑴列出计算该碱金属原子量的数学表达式: ;
⑵无水氯化钙的作用 ;
⑶如果不用氯化钙,求出的原子量比实际原子量偏大还是偏小 。
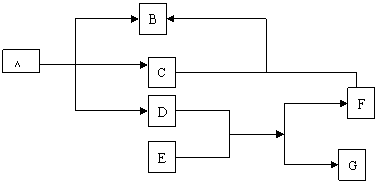
四、推断题24 、(8分) A 、 B 、C、F四种化合物与单质E、G的转化关系如图所示,又知A、B、E、F的焰色反应为黄色。请填写下列空白:
 加热
加热
(1)固体E加入液体D中的现象 。
(2)A加热分解的反应方程式 。
(3)C气体通入F的溶液中的离子方程式 。
计算题(6分)
1. 25、(6分)在标准状况下,8.96L的甲烷和CO的混合气体的质量为7.6克。试回答下列问题:
[1] 混合气体的平均相对分子质量为多少 ?
[2] 混合气体中甲烷的体积多少?
[3] 混合气体中CO的质量多少 ?
附加题 (5分) 27、0.5molA元素的原子被氧化为简单离子需要失去1mol电子。0.4gA的单质与足量盐酸反应生成上述A的阳离子时,可放出0.02g氢气。通过计算确定A是什么元素
28(5分) 把2.48g MgCl2和MgSO4的混合物溶于约45 mL水中,滴加0.2 mol/L BaCl2溶液40 mL恰好沉淀完全。求原混合物中MgCl2和MgSO4的物质的量之比。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | A | C | C | B | D | C | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | C | B | B | A | C | D | B | B | C |
二填空题(每个空2分共40分)
21、填表:
| 实验操作 | 实验现象 | 离子反应方程式 |
| 一小块钠投入FeCl3 溶液中 | (1)溶液中有气泡,(2)有红褐色沉淀,(3)溶液颜色变浅 | 6Na+6H2O+2Fe3+=6Na+ +2Fe(OH)3+3H2 |
| 碳酸钠与醋酸溶液 混合 | 溶液中有气泡, | CO32-+2CH3COOH=CH3COO-+CO2+H2O |
| 盐酸加入KHCO3 溶液中 | 溶液中有气泡, | H++HCO3-=CO2+H2O |
1、1.6克某物质含有3.01×1022个分子,则该物质的相对分子质量为___32_________,摩尔质量为___32g/mol___。
2.、物质的量为1mol的12C中含有___NA______个12C,它们的质量是__0.012_______kg,含有同数目的氧气分子的物质的量是___1_____mol,质量是___0.032________kg。
3.212克Na2CO3溶于水可电离出__4______mol Na+,_2____molCO32-,将这些CO32-完全沉淀,需要_2___molCaCl2,最多可制取__2__mol气体。
4、下列物质中,物质的量最大的是____A_______,含分子个数最多的是_A_____,含原子个最多的是______C____,质量最大的是______D____。(均填字母)
A、6克H2 B、0.5摩尔CO2 C、92克C2H5OH D、148克H2SO4
E、 1.2×1024个HCl分子 F、4℃时10ml水
三、实验题
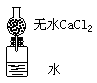 23、(6分)为了测定某种碱金属的相对原子质量而设计的装置如图。该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中,立即塞紧瓶塞。完全反应后再称量此装置的质量为cg。则:
23、(6分)为了测定某种碱金属的相对原子质量而设计的装置如图。该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中,立即塞紧瓶塞。完全反应后再称量此装置的质量为cg。则:
⑴列出计算该碱金属原子量的数学表达式: b/a+b-c ;
⑵无水氯化钙的作用 吸收水分 ;
⑶如果不用氯化钙,求出的原子量比实际原子量偏大还是偏小 偏小 。
四、推断题24 、(8分) A 、 B 、C、F四种化合物与单质E、G的转化关系如图所示,又知A、B、E、F的焰色反应为黄色。请填写下列空白:
 加热
加热
(1)固体E加入液体D中的现象 浮于水面,熔成小球,在水面上游动,并逐渐减小最后完全消失 。
(2)A加热分解的反应方程式 2NaHCO3=Na2CO3 +CO2+H2O 。
(3)C气体通入F的溶液中的离子方程式 CO2+2OH-=CO2-3+H2O 。
计算题(6分)
25、19、6.72L 、2.8g
26 Ca 27、2/1