新课标高一化学同步测试(A)
第三节 用途广泛的金属材料
一、选择题:(本题共6小题,每小题3分,共18分,每小题只有一个正确答案)
1.下列说法中不正确的是 ( )
A.人类历史上使用最早的合金是青铜
B.司母戊鼎是我国目前已发现的最重的青铜器
C.目前世界上使用量最大的合金是铝合金
D.目前世界上用途最广的合金是钢
2.适宜于制作不锈钢用具的钢是
( )
A.低碳钢 B.中碳钢 C.高碳钢 D.合金钢
3.下列金属中属于黑色金属的是 ( )
A.铁 B.金 C.银 D.铜
4.下列金属中不属于货币金属的是 ( )
A.铁 B.金 C.银 D.铜
5.关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
6.最不适宜于制作炊事用具的金属是 ( )
A.Fe B.Pb C.Al D.Cu
二、选择题(共10小题,每小题4分,计40分,每小题有1—2个正确答案,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。)
7.下列物质中,不属于合金的是 ( )
A. 硬铝 B.黄铜 C. 钢铁 D.水银
8.把生铁冶炼成碳素钢要解决的主要问题是 ( )
A.除去生铁中的各种杂质,把生铁提纯
B.适当降低生铁里的含碳量,除去大部分硫、磷等有害杂质
C.用还原剂把铁的氧化物还原成铁
D.加入合金元素改善生铁性能
9.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在下列使用场合中,必须加以控制的是 ( )
A.制造炊具 B.制防锈油漆 C.制牙膏皮 D.炼铝厂制造铝锭
10.在电子工业中,制印刷电路时,常用氯化铁溶液作为铜的“腐蚀液”,该过程发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2。该反应利用了铜的什么性质
( )
A .氧化性 B.还原性
C.导电性 D. 导热性
11.金属及其制品在腐蚀介质中很容易被腐蚀,其使用寿命大为降低。因此只有对腐蚀介质中的金属及其制品采取防护措施,才能保证金属工艺设备的安全性和工农业生产的顺利进行。下面对金属及其制品的防护措施中错误的是 ( )
A.铁锅用完后,用水刷去其表面的油污,置潮湿处保存
B.通过特殊工艺,增加铝制品表面的氧化膜
C.对于易生锈的铁制品(如防护网)要定期涂刷防护漆
D.把Cr、Ni等金属加入到普通钢里制成不锈钢
12.铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是 ( )
A. 测定密度 B. 放入硝酸中 C. 放入盐酸中 D. 观察外观
13.2003年10月15日,我国成功发射“神舟五号”载人飞船,飞船以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为:2NH4ClO4 N2↑+Cl2↑+2O2↑+4H2O。下列有关叙述正确的是 ( )
A.该反应属于分解反应、氧化还原反应
B.上述反应瞬间能产生大量高温,高温是推动飞船飞行的主要因素
C.铝粉的作用是,点燃时氧化放热引发高氯酸铵反应
D.在反应中NH4ClO4仅起到氧化剂作用
14.2000年5月,在香港拍卖会上,保利集团花费3000多万港币购回火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器时间较长容易出现铜绿,其主要成分是
[Cu2(OH)2CO3]。这三件1760年铜铸的国宝在240年后看上去依然熠熠生辉,不生锈,下列对其原因的分析,最可能的是 ( )
A.它们的表面都镀上了一层耐腐蚀的黄金
B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C.铜的金属活动性比氢小,因此不易被氧化
D.它们是含一定比例金、银、锌的铜合金
15.烟花的主要成分是氧化剂、还原剂、着色剂。下列几种配方较合理的是 ( )
A.KNO3、C、S B.KClO3、KNO3、S
C.Sr(NO3)2、KNO3、Mg-Al粉 D.Ca(NO3)2、KNO3、Mg-Al粉
16.足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为 ( )
A 1︰2 B 3︰2 C 3︰1 D 6︰1
三、填空题:
17.(8分)物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性、②导电性、③还原性、④延展性、⑤具有金属光泽。请在下面金属用途后的横线上填上金属性质对应的序号。
(1)用铝定制成包装用的铝箔 ;
(2)用铝制成的高压铝锅 ;
(3)用铁粉回收照相业废液中的银 ;
(4)电信业中大量使用的铜丝、金属电缆 。
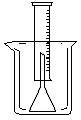 18.(12分)测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品: 800mL烧杯、100mL量筒、短颈漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g/L)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100mL)
18.(12分)测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品: 800mL烧杯、100mL量筒、短颈漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g/L)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100mL)
补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
② ;
③ ;
④ 。
19.(9分)铜是生命必要的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜(即:曾青(CuSO4)跟铁反应生成铜),试写出该反应的离子方程式: 。
(2)尽管铜比铁较为稳定,但铜器表面经常会生成铜锈 [即:铜绿,化学式Cu2(OH)2CO3], 其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法: 。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃)
。
20.(13分)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况)。据此计算:
(1)加入铝粉的质量。
(2)原硫酸铜溶液的物质的量浓度。
参 考 答 案
一、选择题1.C 2. D 3. A 4.A 5.D 6.B
二、选择题7.D 8.B 9.AC 10.B 11.A 12.D 13.AC 14.D 15.CD 16.C
三、填空题
17.(1)④;(2)①;(3)③;(4)②
18.
②往烧杯中注入水,直至水面没过漏斗颈。(没答水面没过漏斗颈不给分)
③在100毫升量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中。烧杯中水面到杯口至少保留约100毫升空间。
④将长颈漏斗(或答玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生
19.
(1) Fe+Cu2+=Fe2++Cu
(2) 干燥空气中保存
(3) 铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型。
20解:发生反应的离子方程式为 3Cu2++2Al 3Cu+2Al3+ …… ①
Al3++4OH— AlO2—+2H2O
……② 2Al+2OH—+2H2O 2AlO2—+3H2↑……
③
由题可知n(H2)=![]()
则反应③消耗的n(NaOH)=0.0200mol n(Al)=0.0200mol
反应②消耗的n(NaOH)=2.00mol·L-1×0.210L-0.0200mol=0.400mol
则反应①消耗的n(Al)=0.100mol,n(Cu2+)=0.150mol
故加入铝粉的质量为 m(Al)=(0.100mol+0.0200mol)×27.0g·mol-1=3.24g
硫酸铜溶液的浓度为c(CuSO4)=![]()