第二章 化学物质及其变化检测题
班级 学号 姓名 得分
(满分100分)
一、选择题(本题共20 小题,每小题2分,共40分。每小题只有一个正确选项)
1.下列电离方程式,书写正确的是…………………………………………….( )
A. Al2(SO4)3 =2Al3+ + 3SO42- B.AlCl3 = Al3+ Cl3-
D. Mg(NO3)2 = Mg+2 +2NO3- D.KMnO4 =K+ +Mn7+ +4O2-
2.下列说法正确的是………………………………………………………………( )
A.易溶于水的物质一定是电解质 B.液态氯化氢能导电
C.液态氯化钠能导电 D.熔融的液态钠是电解质
3.下列反应中,铁元素被氧化的是…………………………………………….( )
A.FeS +2HCl = FeCl2 + H2S↑ B. Fe +H2SO4 = FeSO4 +H2↑
C. FeO + 2HCl =FeCl2 +H2O D. Fe2O3 +3CO = 2Fe +3CO2
4.下列离子反应方程式,书写正确的是………………………………………….( )
A. 向碳酸钠溶液中加盐酸 CO32- + 2H+ = H2O +CO2 ↑
B.向稀硫酸溶液中投入铁粉 2Fe +6H+ = 2Fe3+ +3H2 ↑
C. 向盐酸中投入碳酸钙 CO32- + 2H+ = H2O +CO2 ↑
D.氢氧化钡溶液中加入硫酸 H+ + OH- =H2O
5.下列关于分散系的说法,正确是………………………………………………( )
A.稀硫酸不是分散系
B.一种分散系里只有分散质和分散剂两种物质
C.分散剂一定是液体
D.按分散质和分散剂的状态(气、液、固态),有9种组合方式的
6.下列各组,可用交叉分类法进行分类的是…………………………………..( )
A.Na2CO3 、Na2SO4、K2CO3、K2SO4 B.石灰石、氯化钙、纯碱、氯化钠
C.干冰、一氧化碳、石墨、金刚石 D.氢气、盐酸、苛性碱、小苏打
7.下列基本反应类型中,一定是氧化还原反应的是…………………………….( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
8.下列各组分散系,需用丁达尔效应区分的是………………………………….( )
A. 溶液和浊液 B. 胶体与胶体
C. 溶液与胶体 D. 溶液与溶液
9.在水溶液中能大量共存,且加入过量稀硫酸溶液时,有气体生成的是………( )
A. Na+ 、 Ag+ 、CO32- 、Cl- B. K+ 、 Ba2+ 、 SO42- 、 Cl-
C. Na+ 、 K+ 、CO32- 、Cl- D. Na+ 、K+ 、 Cl- 、 SO42—
10.农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的硫酸铜反应,在该反
应中,铁做了…………………………………………………………………….( )
A.氧化剂 B.还原剂 C.被还原 D.既不是氧化剂也不是还原剂
11.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2
连接好线路发现灯泡亮,由此得出的结论正确的是………………………..( )
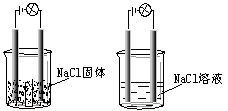 A. NaCl是非电解质
A. NaCl是非电解质
B. NaCl溶液是电解质。
C. NaCl在水溶液中电离出了可以
自由移动的离子。
|
12.下列说法错误的是……………………( )
A.分类方法应用广泛 B.纳米级粒子与胶体粒子的尺寸大致相当
C.胶体属于介稳定系 D.区分胶体与溶液的方法必须用丁达尔现象
13.下列各组微粒中,在一定条件下均可以做氧化剂的是………………………( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
14.将饱和FeCl3溶液分别滴入下列溶液或水中,能形成胶体的是…………….( )
A.冷水 B.煮沸的蒸馏水
C.NaOH浓溶液 D.NaCl浓溶液
15.氢化钙中的氢元素为—1价,它可用做生氢剂,反应的化学方程式是:
CaH2+2H2O==Ca(OH)2+2H2↑。该反应中,水的作用是……………………..( )
A.溶剂 B.还原剂 C.氧化剂 D.既是还原剂又是氧化剂
16.以水为分散剂的分散系,按稳定性由强到弱的顺序排列的是………………( )
A. 溶液、胶体、浊液 B. 浊液、胶体、溶液
C. 胶体、浊液、溶液 D. 浊液、溶液、胶体
17.正确书写离子方程式时,应使等号两边………………………………………….( )
A.离子的物质的量相等 B.微粒的总的数量应相等
C.正电荷和负电荷总数应相等 D.电荷量和各元素原子的物质的量应相等
18.下列变化中,必须加入氧化剂才能发生的是…………………………………..( )
A. SO2→S B. SO32—→SO2 C. I- →I2 D. HCO3—→CO32—
19.酸性高锰酸钾溶液是化学实验中一种常用强氧化剂。下列溶液中肯定不能用于酸化高
锰酸钾溶液的是………………………………………………………………….( )
A.HNO3 B. NaHSO4 C.H2SO4 D.HCl
20.某元素在化学反应中由化合态变为游离态,则该元素……………………….( )
A.一定被氧化了 B.一定被还原了
C.既可能被氧化也可能被还原 D.既不可能被氧化,也不可能被还原
二、填空题(本题8小题,共26分)
21.(2分)胶体粒子的大小在 之间,丁达尔效应是由于胶体粒子对 形成的。
22.(3分)实验室制取Fe(OH)3 胶体的方法是: 取一个小烧杯,加入25ml蒸馏水。将烧杯的蒸馏水加热至 ,向 中逐滴加入1~2mlFeCl3溶液。继续
至溶液呈红褐色,停止加热,即得到Fe(OH)3 胶体。
23.(3分)写出下列物质在水溶液里的电离方程式:
(1)硫酸铁 ;(2)氢氧化钡 ;
(3)氯酸钾 。
24.(3分)写出下列物质间反应的离子反应方程式:
(1)硫酸钠溶液与氯化钡溶液 ;
(2)盐酸与碳酸钠溶液 ;
(3)硝酸银溶液与氯化钾溶液 。
25.(4分)将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,均有 产生,它们的离子反应方程式是 ,说明离子反应方程式不仅表示一定物质间的 ,而且表示了 离子反应。
26.(4分)锌粒投入稀硫酸中,溶液里 离子的量减少, 离子的量增加, 离子的量没有变化,反应的离子方程式为 。
27.(3分)对于司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学反应如下:
2CrO3+ 3CH3CH2OH + 3H2SO4= Cr2 (SO4)3 + 3CH3CHO + 6H2O
(1)被检测的气体成分是 ;
(2)其中氧化剂是 ,氧化产物是
28.(4分)阅读下列材料后,回答相应问题。
一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。
(1)人体中经常进行![]() 的转化,A中Fe2+做
剂,B中Fe3+做
剂。
的转化,A中Fe2+做
剂,B中Fe3+做
剂。
(2) “服用维生素C,可使食物中的三价铁离子还原成二价铁离子。”这句话指出维生素C在这一反应中做 剂,具有 性。
三、简答及推断题(本题4小题,共30分)
29.(12分)根据教材中的分类方法作答:
(1)(4分)根据交叉分类法,请用斜线将下面框图的酸与酸的分类连接起来:

(2)(8分)根据树状分类法,请将:均匀混合物、非均匀混合物、有机化合物、无机化合物、单质、化合物、金属单质、非金属单质,填入下图的方框中。
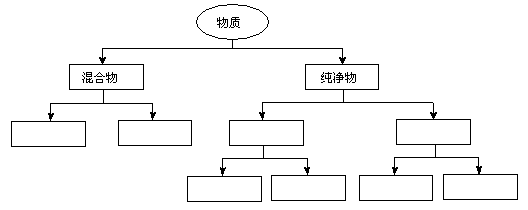 |
30.(6分)现有四瓶溶液,分别是H2SO4、BaCl2、Na2SO4、Na2CO3中的一种,根据以下实验,请分别确认A、B、C、D各是什么物质?
A加入B中无反应。A加入C中有气体产生,D加入A中有沉淀产生。
则:A:________; B:________;C:_________;D:___________。
写出A与C、A与D反应的离子方程式。______________________________________;
______________________________________________________________________。
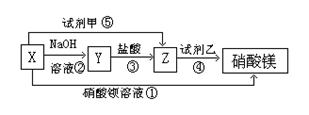 31.(8分)X、Y、Z三种物质有如图所示转化关系:
31.(8分)X、Y、Z三种物质有如图所示转化关系:
(1)根据上述转化关系,写出下列物质的化学式:X 、Y 、Z 试剂甲 ,试剂乙 。
(2)写出上述各步反应①~⑤的离子方程式:
① ;② ;
③ ;④ ;
⑤ 。
32.(8分)写出符合下列条件的反应方程式:
(1)一种单质氧化一种化合物: ;
(2)一种单质还原一种化合物: ;
(3)同一种化合物的一种元素氧化另一种元素: ;
(4)一种化合物氧化另一种化合物: 。
第二章 化学物质及其变化参考答案及评分标准
一、选择题(本题共20 小题,每小题2分,共40分)
1.A 2.C 3.B 4.A 5.D 6.A 7.C 8.C 9.C 10.B 11.C 12.D 13.B
14.B 15.C 16.A 17.D 18.C 19.D 20.C
二、填空题(共26分)
21.(2分)1~10nm;光线的散射作用
22.(3分)沸腾,沸水,煮沸
23.(3分)Fe2(SO4)3 = 2Fe3+ + 3SO42- ; Ba(OH)2 =Ba2+ +2OH-
KClO3 = K+ +ClO3-
24.(3分)SO42- +Ba2+ =BaSO4 2H+ +CO32- =H2O +CO2↑ Ag+ + Cl- =AgCl↓
25.(4分)白色沉淀;Ag+ + Cl- =AgCl ;某一具体反应,同一类型
26.(4分)H+ , Zn2+ ,SO42-。 2H+ +Zn = Zn2+ + H2↑
27.(3分)(1)乙醇(C2H5OH) (2) CrO3 CH3CHO
28.(4分) (1)还原剂 氧化剂 (2)还原剂 还原性
三、简答及推断题(共30分)
29(12分,答:略)
30.(6分)A. H2SO4 B. Na2SO4 C. Na2CO3 D. BaCl2
2H+ +CO32- =H2O +CO2↑ SO42- +Ba2+ =BaSO4↓
31.(8分)X: MgSO4 Y : Mg(OH)2 Z: MgCl2
① SO42- +Ba2+ =BaSO4↓
② Mg2+ +2OH- = Mg(OH)2↓
③ Mg(OH)2 +2H+ = Mg2+ +2H2O
④ Ag+ + Cl- =AgCl↓
⑤ SO42- +Ba2+ =BaSO4↓(每答1分)
32.(8分,合理答案均给分)