高一化学反应与能量单元测试题(A卷)
(40分钟)
可能用到的原子量:
H = 1 C = 12 N = 14 O = 16 Na = 23 Al = 27
一、选择题:( 共14个小题,每题有1~2个选项符合题意,每题4分,共56分。)
1、下列变化一定是吸热反应的是:
A、凡需加热后才能发生的反应
B、所有的分解反应
C、将热能转变为化学能的反应
D、生成物总能量大于反应物总能量的反应
2、化学反应的特征是
A、发光发热 B、能量发生变化
C、状态发生变化 D、有新物质生成
3、下列各组中的两个反应,前一个反应放出的热量比后一个反应放出的热量多的是(反应物参与反应的物质的量均按化学方程中的化学计量数计算)
![]() ① 2H2(g)+ O2(g)
= 2H2O(g) 2H2(g)+
O2(g) = 2H2O(l)
① 2H2(g)+ O2(g)
= 2H2O(g) 2H2(g)+
O2(g) = 2H2O(l)
② C(s)+ O2(g) = CO2(g) C(s)+ O2(g) = CO(g)
A、只有① B、只有② C、①② D、①②都不符合题意
4、把纯碘化氢气体装入密闭容器中,它将按2HI ≒ H2 + I2反应进行分解(正反应吸热),当系统在趋向平衡状态的过程中,以下描述正确的是:
A、碘化氢的生成速率大于其分解速率
B、碘化氢的生成速率等于其分解速率
C、加催化剂不会影响达到平衡的时间
D、升高温度可以加快平衡状态的到达
5、氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是
A、 H2通入负极区 B、O2通入正极区
C、负极反应为2H2 + 4OH- — 4e- = 4H2O D、正极发生氧化反应
6、X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为:
A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X
7、将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率。① Ʋ(N2) = 0.15 mol/(L·min) ② Ʋ(N2) = 1.05 mol/(L·min)
③ Ʋ(NH3) = 0.30 mol/(L·min) 其中正确的是
A、①② B、②③ C、①③ D、①②③
8、下列措施对增大反应速率明显有效的是:
A、Na与水反应时增大水的用量
B、Fe与稀硫酸反应制取氢气时,改用浓硫酸
C、在K2SO4与BaCl2两溶液反应时,增大压强
D、将铝片改为铝粉,做铝与氧气反应的实验
9、已知可逆反应2SO2 + O2 2SO3,当生成2 mol SO3时放出热量为Q,
![]() 现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则
A、Q1 = Q B、Q1 < Q C、2Q1 > Q D、无法判断
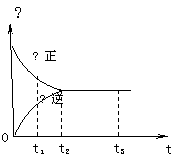 10、右图是可逆反应X2
+ 3Y2
10、右图是可逆反应X2
+ 3Y2 ![]() 2Z2 在反应
2Z2 在反应
过程中的反应速率(Ʋ)与时间(t)的关系曲线,
下列叙述正确的是
A、t1时,只有正方向反应
B、t2时,反应到达限度
C、t2- t3,反应不再发生
D、t2- t3,各物质的浓度不再发生变化
11、在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s末的V(H2)=0.3mol/(L•s),则3s末NH3的浓度为:
A、0.4mol/L B、0.6mol/L C、0.9mol/L D、1.2mol/L
12、一定温度下可逆反应N2(g) + 3H2(g) ≒ 2NH3(g)达平衡的标准是:(分别用V表示正反应速率,V╯表示逆反应速率)
A、V(N2) = V╯(N2) B、V(N2) = 3V(H2)
C、V(H2) = 3/2V╯(NH3) D、N2,H2,NH3的体积比为1:3:2
13、将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是
①使煤充分燃烧,提高煤能的利用率 ②减少SO2的产生,避免造成“酸雨”③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A、①②③ B、②③④ C、①③④ D、①②③④
14、金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A、Q1 < Q2
B、石墨不如金刚石稳定
C、石墨具有的能量比金刚石低
D、石墨与金刚石完全燃烧,生成的二氧化碳一样多
二、非选择题(共44分)
15、(12分)列举下列能量转变在生产或生活中实际应用的例子,并写出有关反应的化学方程式
(1)化学能转变为热能 ;
(2)热能转变为化学能 ;
(3)化学能转变为电能 ;
(4)电能转变为化学能 。
16、(11分)拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:
则1mol N2生成NH3 热量(填:吸收或放出) kJ;
1mol H2生成NH3 热量(填:吸收或放出) kJ;
理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;
事实上,反应的热量总小于理论值,为什么?
。
17、(12分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是
② 哪一段时段的反应速率最小 ,原因是
③ 求2 ~ 3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)
④ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A 蒸馏水、B NaCl溶液、C NaNO3溶液、D CuSO4溶液、E Na2CO3溶液,你认为可行的是 。
18、(9分)现有如下两个反应:(A)NaOH + HCl = NaCl + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池
(2)如果不能,说明其原因
(3)如果可以,则写出正、负极材料及其电极反应式,电解质溶液名称
。
参考答案
一、每题4分,共56分:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CD | BD | B | D | D | C | C |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | B | BD | B | AC | A | B |
二、
15、任何合理的例子均可,但要有实用意义,若举Cu—2n(H2SO4)原电池,则无实用意义。(12分)
16、放出(1分),92(2分);放出(1分),30.67(2分);放出(1分),46.2(2分);该反应是可逆反应,充分反应的最终结果是达到最大限度(既化学平衡状态),因此放出的热量总是小于理论计算值。 (2分)
17、(12分)① 2~3 min ,因该反应是放热反应,此时温度高。(2分)
② 4~5 min ,因为此时H+ 浓度小。(2分)
③ 0.1 mol/L·min(4分)
④ A、B; (4分)
18、(1)(A)不能,(B)可以(各1分)
(2)(A)的反应非氧化还原反应,没有电子转移(2分)
(3)负极:铜,Cu — 2e- = Cu2+
正极:碳棒,2Fe3+ + 2e- = 2Fe2+
电解质溶液:氯化铁溶液(各1分)