化学必修II《化学反应与能量》单元测试题(B卷)
(40分钟)
可能用到的原子量:
H = 1 C = 12 N = 14 O = 16 Na = 23 Al = 27
一、选择题:( 共14个小题,每小题只有一个选项符合题意,每题4分,共56分。)
1、下列说法正确的是
A. 凡是放热反应的发生均无需加热
B.凡是需要加热后才能发生的反应是吸热反应
C.伴有能量变化的物质变化都是化学变化
D. 物质发生化学反应都伴随着能量变化
2、氢气是未来的理想能源,理由是:
①热值高 ②燃烧时不污染环境 ③用于制取H2的水资源丰富 ④密度小,便于运输
A、①②③ B、②③④ C、①③④ D、①②③④
![]() 3、对于放热反应H2 + Cl2 点燃 2HCl,下列说法正确的是:
3、对于放热反应H2 + Cl2 点燃 2HCl,下列说法正确的是:
A、产物所具有的总能量高于反应物所具有的总能量
B、反应物所具有的总能量高于产物所具有的总能量
C、断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成
1mol H—Cl键所放出的能量
D、该反应中,化学能只有转变为热能
4、下列反应既属于氧化还原反应,又是吸热反应的是:
A、锌粒与稀硫酸的反应
B、灼热的木炭与CO2的反应
C、甲烷在空气中燃烧的反应
D、Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
5、近年来,广州市的大部分公交车及部分出租车已采用LPG(液化石油气)作燃料,其主要的目的在于:
A、解决石油短缺问题 B、降低成本
C、减少对大气的污染 D、加大发动机的动力
6、将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是:
A、溶液的PH增大 B、溶液中的Zn2+浓度增大
C、溶液中的SO42- 浓度增大 D、溶液的密度增大
7、废电池的污染引起人们广泛注意,废电池对环境造成污染的主要物质是:
A、锌 B、汞 C、石墨 D、二氧化锰
8、已知空气――锌电池的电极反应为:
锌片:Zn + 2OH- - 2e- = ZnO + H2O
石墨:O2 + 2H2O + 4e- = 4OH-
根据此判断,锌片是:
A、负极,并被氧化 B、负极,并被还原
C、正极,并被氧化 D、正极,并被还原
9、X,Y,Z都是金属,把X浸入Z的硝酸盐溶液中,X表面有Z析出,X与Y组成原电池时,Y为负极。X,Y,Z三种金属的活动性顺序为:
A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X
10、可逆反应2SO2
+ O2 ![]() 2SO3达到平衡的标志是
2SO3达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A、①② B、①③ C、只有③ D、只有①
11、在反应:C + CO2 ≒ 2CO中,可使反应速率增大的措施是:
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A、①②③④ B、②③④⑤ C、①②③ D、②③④
12、下列实验中,反应速率加快是由催化剂引起的是:
A、在炭粉中加入KClO3,点燃时燃烧更为剧烈
B、锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快
C、固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀
D、双氧水中加入少量MnO2,即可迅速放出气体
13、下列变化是因原电池反应而引起的是
A、在空气中金属铝表面迅速氧化形成保护膜
B、常温下,铁被浓硫酸“钝化”形成保护膜
C、在潮湿的空气中钢铁易生锈 D、在潮湿的空气中过氧化钠易变质
14、在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
A、0.1mol.L-1.min-1 B、0.2mol.L-1.min-1
C、0.3mol.L-1.min-1 D、0.6mol.L-1.min-1
二、非选择题(共44分)
15、(6分)芒硝(Na2SO4•10H2O)是重要的化工原料,具有广泛的用途。芒硝可调节室内温度,科学家利用太阳能的方法之一,是将装有芒硝的密闭聚乙烯管安装在房屋的外墙内,当太阳照射时,它能将太阳能转化为化学能,达到蓄热效果,使室内保持较低温度;晚上,它能将化学能转化为热能,使室内保持温度。请结合方程式解析其原因。
16、(6分)将20g Ba(OH)2•8H2O固体与10g NH4Cl晶体在烧杯中混合,不断搅拌,实验现象为:
,
该反应的化学方程式:
17、(12分)对于反应X(g) + Y(g) = Z(g),下列图象表示反应速率与反应物浓度、温度、时间之间的关系(考虑某一因素时,其它条件保持不变)
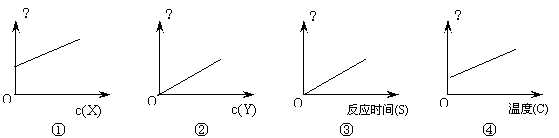 |
判断各图象表示的关系是否正确,如果错误,说明理由;如果正确,说明曲线的念义
①
②
③
④ 。
18、(12分)拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:
则1mol N2生成NH3 热量(填:吸收或放出) kJ;
1mol H2生成NH3 热量(填:吸收或放出) kJ;
理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;
事实上,反应的热量总小于理论值,为什么?
。
19、(8分)选择适宜的材料和试剂设计一个原电池,以便完成下列反应。
Zu + CuSO4 = ZuSO4 + Cu
(1)画出装置图:
(2)电极材料和电解质溶液各是什么?
(3)写出电极反应式:
参考答案
一、每题4分,共56分:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| D | A | B | B | C | C | B |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| A | C | C | C | D | C | B |
二、
15、Na2SO4•10H2O 吸热放热 Na2SO4•nH2O + (10-n)H2O (n<10) (3分)
由于芒硝随环境温度的变化,会得失结晶水,在得失结晶水的过程中伴随着能量的变化,因此,芒硝可作储能材料。 (3分)
16、容器外壁变冷(1分),固体变成糊状(1分),有刺激性气体放出(1分);
Ba(OH)2•8H2O + 2NH4Cl = BaCl2 + 2NH3•H2O + 8H2O (3分)
17、(每小题3)
① 错误,c(X)为0时,不可能发生反应。
② 正确,反应物Y的浓度增大,反应速率也加快。
③ 错误,随着反应的时间延长,反应速率应逐渐减小。
④ 正确,反应的温度升高,反应速率也加快。
18、放出(1分),92(2分);放出(1分),30.67(2分);放出(1分),46.2(2分);该反应是可逆反应,充分反应的最终结果是达到最大限度(既化学平衡状态),因此放出的热量总是小于理论计算值。 (3分)
19、(1)略。 (3分)
(2)锌片、铜片(合理答案即可,各1分);CuSO4溶液(1分)
(3)负极:Zn – 2e- = Zn2+ (1分) 正极:Cu2+ + 2e- = Cu (1分)