|
高一化学下学期6月份月考
化 学
注意事项:
1.本试卷分为第一卷(选择题)和第二卷(非选择题)两部分。
2.作答第一卷前,请考生务必将自己的姓名.考试号用0.5mm的黑色签字笔填写在答
题卡上,并用2B铅笔将考号填涂正确。
3.作答第二卷时,请用0.5mm的黑色签字笔在答题纸的指定区域内作答,在试题卷上
答题一律无效。
4.作图题可先用2B铅笔作答,确认后,再用0.5mm的黑色签字笔描写清楚。
5.本试卷中可能用到的相对原子质量:H—1 C—12 O—16
第Ⅰ卷(选择题 共74分)
一、选择题(本大题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符
合这一主题的是 ( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
2.广告称某品牌的八宝粥(含桂圆.红豆.糯米)不加糖,比加糖还甜,适合糖尿病人食
用。你认为下列判断不正确的是 ( )
A.这个广告有误导喜爱甜食消费者的嫌疑
B.糖尿病人应少吃含糖的食品,该八宝粥未加糖,可以放心食用
C.不加糖不等于没有糖,糖尿病人食用需慎重
D.不能听从厂商或广告商的宣传,应询问医生
3.下列气体的主要成分不是甲烷的是 ( )
A.沼气 B.天然气 C.煤气 D.坑道气
4.通常用来衡量一个国家的石油化学工业发展水平的标志是 ( )
A.乙烯的产量 B.石油产量
C.合成纤维的产量 D.硫酸的产量
5.下列各原子或离子的电子排布式错误的是 ( )
A.S2- 1S22S22P63S23P4 B.F 1S22S22P5
C.K+ 1S22S22P63S23P6 D.Ar 1S22S22P63S23P6
6.下列物质中,既含有极性共价键,又含有非极性共价键的是 ( )
A.CCl4 B.C2H4 C.CO2 D.NH4Cl
7.在下列分子中,存在手性碳原子的是 ( )
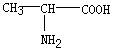 A.
A.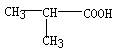 B.
B.
![]()
![]() C. D.
C. D.
8.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4.SiH4.GeH4.SnH4的熔点随分子质量的增大而升高
D.HF.HCl.HBr.HI的热稳定性依次减弱
二.选择题(本大题包括10小题,第9—16题每小题4分,第17.18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给满分,但只要选错一个该小题就为0分)
9.下列数值中,能反映同周期中ⅡA族元素原子序数(m)和ⅢA族元素原子序数(n)之间的
关系的选项是 ( )
A.n=m+1 B.n=m+10 C.n=m+25 D.无法确定
10.已知:(1)醇类物质在催化剂存在条件下可发生类似于乙醇的脱氢氧化。
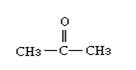
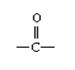
(2)羰基( )与两个烃基相连构成的化合物叫酮(如丙酮); 而分别与烃基和氢相连构成的化合物叫醛(如乙醛CH3CHO)。下列醇被氧化时,不可能得到醛类化合物的是 ( )
A.(CH3)3COH B.CH3CHOHCH3
C.CH3CH2CH2OH D.(CH3)3CCH2OH
11.下列分子的结构中,原子的最外层电子不都满足8电子稳定结构的是 ( )
A.CO2 B.PCl3 C.CCl4 D.NO2
12.有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是:①H原子得到一个电子实现最外电子层稳定结构;②氢分子的结构式为H—H;③与碱金属元素形成离子化合物M+[∶H]-;④分子中原子间的化学键都属于非极性键 ( )
A.只有①②③ B.只有①③④
C.只有②③④ D.有①②③④
13.下列化学用语,不能表示氯离子的是 ( )
A.Cl—
B.![]()
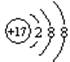
C. D.1s22s22p63s23p6
14.以下现象与核外电子的跃迁有关的是 ( )
①霓虹灯发出有色光 ②棱镜分光
③激光器产生激光 ④石油蒸馏
⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花
⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
15.关于原子轨道的说法正确的是 ( )
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而
形成的
C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道
D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键
16.有人将金属冶炼的方法分为以下四种:
①焦炭法; ②水煤气(或H2.CO)法;
③活泼金属置换法; ④电解法。
古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石(KCl·MgCl2·6H2O)中炼镁。对它们的冶炼方法分析不正确的是( )
A.(Ⅰ)属① B.(Ⅱ)属②
C.(Ⅲ)属③ D.(Ⅳ)属④
17.从海水里提取溴的过程中,有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与上述反应在原理上最相似的反应是 ( )
A.2NaBr+Cl2=Br2+2NaCl B.Br2+SO2+2H2O=2HBr+H2SO4
C.2H2S+SO2=3S+2H2O D.Cl2+H2O=HCl+HClO
18.某烃的结构简式为![]() ,它可能具有的性质是
( )
,它可能具有的性质是
( )
A.它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B.它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C.易溶于水,也易溶于有机溶剂
D.能发生加成反应,一定条件下可与四倍物质的量的氢气加成
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共22分)
19.实验室通过简单的“试管实验”,即可探究元素金属性.非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
试剂:镁条.铝条.氯水.AlCl3溶液.MgCl2溶液.NaBr溶液.氢硫酸.水.NaOH溶液
| 实验方案 (只要求填写选用试剂) | 实验现象 | 结论 | |
| (1) | 一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 | 金属性: Mg > Al | |
| (2) | 非金属性: | ||
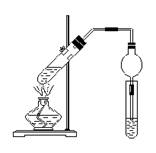 20.用右图所示的实验装置制取乙酸乙酯。
20.用右图所示的实验装置制取乙酸乙酯。
(1)制取乙酸乙酯的反应是 反应,将所得乙
酸乙酯及时蒸出,目的是
。
(2)左边的试管发生反应的化学方程式为:
,加入两
小块碎瓷片的作用是
。
(3)右边试管中加入的物质是 ;
试管中可以观察到的现象是 。实验中球形干燥管的作用除了使乙酸乙酯充分冷凝外,还可以 。
四、(本题包括2小题,共21分)
21.下图是N.O.F三种元素基态原子电子排布的轨道表示式。试回答下列问题:
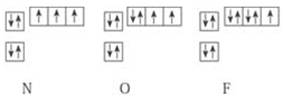
(1)N.O.F形成氢化物的分子组成,与对应的三种元素基态原子内的电子排布有什么关系?
 (2)在右边的方框内,画出C原子基态原子电子排布
(2)在右边的方框内,画出C原子基态原子电子排布
的轨道表示式。
(3)根据你发现的规律,对基态C原子形成CH4分子
的微观过程提出合理的猜想。
22.下面是s能级p能级的原子轨道图,试回答问题:
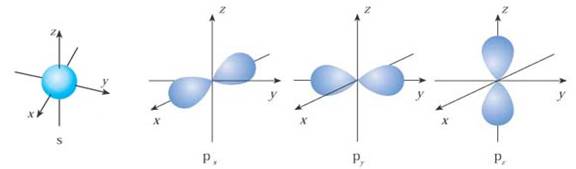 (1)s电子的原子轨道
(1)s电子的原子轨道
呈 形,每个s能级有 个原子轨道;p电子的原子轨道呈 形,每个p能级有 个原子轨道。
(2)s电子原子轨道.p电子原子轨道的半径与什么因素有关?是什么关系?
五、(本题包括2小题,共20分)
23.短周期主族元素A.B.C.D的原子序数依次增大,其中A.C同主族,B.C.D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A在元素周期表中的位置_______________。
(2)A.B.C三种元素形成的简单离子的半径由大到小的顺序是__________________(填写离子符号)。
(3)CA2与D元素的单质在水溶液中反应的离子方程式是_________________________。
(4)C元素常见的化合价有—2.+2.+4.+6等,C与A.B.D均能形成各原子(或离子)都满足最外层8电子稳定结构的化合物,请你大胆猜想,写出其中两种化合物的化学式 ____________________。
24.某有机物A由C.H.O三种元素组成,15g A完全燃烧可生成22g CO2 和9g水。试求:
(1)该有机物的最简式 。
(2)若符合该最简式的A物质可能不止一种,则它们之间的关系 。(填序号)
A.一定互为同系物 B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
(3)若A与碳酸钠溶液反应有气体放出,则该反应的化学方程式为:
。
(4)若A是具有水果香味的液体,可发生水解反应,则A的结构简式为 。
(5)若A的相对分子质量为180,能发生银镜反应,也能发生酯化反应,则A的分子式为 。
五、(本题包括2小题,共13分)
25.硝酸(HNO3)是一种一元强酸,分子中唯一的H原子与 原子通过共价键相连,3个O原子都与 原子通过共价键相连。
关于硝酸的结构,有两种说法目前都被认可:
(1)假如价电子尽可能都参与成键,成键后最外层不一定只有8个电子,则硝酸的结构式是 ;
(2)假如分子中除H原子外的所有原子,成键后最外层均满足8电子,结合配合物理论,你认为课本第56页给出的结构式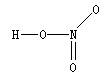 应如何“修正”?
应如何“修正”?
26.现用30g普通冰醋酸(CH3COOH)与28g含有18O的乙醇(CH3CH218OH)在 浓硫酸存在的条件下加热制取乙酸乙酯,如果实际产量是理论产量的80%,可制取乙酸乙酯多少克?
参考答案
一、选择题(本大题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
二、选择题(本大题包括10小题,第9—16题每小题4分,第17.18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给满分,但只要选错一个该小题就为0分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | B | B | C | A | A | B | B | B | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | AB | D | A | B | A | C | B | C | BD |
三、(本题包括2小题,共22分)
19.(1)AlCl3溶液.MgCl2溶液.NaOH溶液
(2)氢硫酸.氯水 有黄色沉淀生成 Cl>S(或NaBr溶液.氯水 溶液由浅黄绿色变成黄色 Cl>Br)(每空2分,共8分)
20.(1)可逆 促进酯化反应正向移动
(2)CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O 防止暴沸
CH3COOC2H5 + H2O 防止暴沸
(3)饱和碳酸钠溶液 液面上有无色透明的油状液体生成,并可闻到一种果香味 防止倒吸 (每空2分,共14分)
四、(本题包括2小题,共21分)
21.(1)1个氢化物分子中的H原子数目等于其对应的基态原子中的未成对电子数(3分)
(2)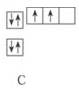 (3分)
(3分)
(3)基态C原子有1个2s电子激发到p轨道,形成4个未成对电子。(3分)
22.(1)球形 1 纺锤 3
(2)与能层序数n有关。能层序数n越大,原子轨道的半径越大。(每空2分,共12分)
五.(本题包括2小题,共20分)
23.(1)第2周期ⅥA族
(2)S2->O2->Na+(2分)
(3)SO2 +Cl2+2H2O=4H++2Cl—+SO42—
(4)Na2S.SCl2.SO等(每空2分,共10分)
24.(1)CH2O
(2)C
(3)2CH3COOH + Na2CO3 → 2CH3COONa + CO2↑+ H2O
(4)HCOOCH3
(5)C6H12O6(每空2分,共10分)
五、(本题包括2小题,共13分)
25.O(1分) N (1分) 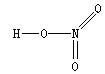 (2分)
(2分) 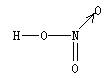 (2分)
(2分)
26.经计算知乙醇过量,故按冰醋酸计算。(2分)
设可制取乙酸乙酯的质量为x,则有:
CH3COOH + H18OCH2CH3 ![]() CH3CO18OCH2CH3
+ H2O (2分)
CH3CO18OCH2CH3
+ H2O (2分)
60g 90g
30g×80% x
x=![]() =36g (3分)
=36g (3分)
答:可制取乙酸乙酯36g。
