高一化学下学期期中考试2
化 学
答题可能用到的相对原子质量:H 1、S 32、Cl 35.5、N 14、O 16、Na 23、Mg 24 、Al 27 、Cu 64、 Zn 65
一、选择题(以下每小题均只有一个符合题意的答案。每小题2分,共20分)
1.元素的性质呈周期性变化的根本原因是 ( )
A.元素原子量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
D.元素的金属性和非金属性呈周期性变化
2.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 ( )
A.HF B.H3O+ C.NaH D.H2O2
3.在2A+B=3C+4D反应中,表示该反应速率最快的数据是 ( )
A.υA = 0.5mol/(L·s) B.υB = 0.3mol/(L·s)
C.υC = 0.8mol/(L·s) D.υD = 1.0mol/(L·s)
4.下列分子中所有原子都满足最外层8电子结构的是 ( )
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
5.迄今为止合成的最重的元素是112号元素,它是用 ![]() 高能原子轰击
高能原子轰击 ![]() 的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是 ( )
的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是 ( )
A.112号元素是金属元素
B.112号元素位于第七周期,是过渡元素
C.科学家合成的112号元素的原子的中子数为166
D.112号元素为放射性元素
6.有A.B.C.d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀.将A.d分别投入等浓度的盐酸中,d比a反应剧烈.将Cu浸入b的盐溶液里,无明显变化.如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
A.D.C.A.b B.D.A.B.c
C.D.B.A.c D.B.A.D.c
7.下列各组物质中,都是共价化合物的是 ( )
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和HClO3
8.下列各组物质的性质顺序,不正确的是 ( )
A.原子半径:Na<Mg<Al B.热稳定性:HCl>HBr>HI
C.酸性强弱:H2SiO4<H2CO3<H2SO4 D.熔点:SiO2>NaCl>CO2
9.当可逆反应在一定条件下达到平衡时,正反应速率v正和逆反应速率v逆的关系是
A.v正>v逆 B.v正<v逆 C.v正=v逆 =0 D.v正=v逆≠0
10.铜片和锌片用导线连接后,插入稀硫酸中,锌片是 ( )
A.正极 B.负极
C.电子流入的一极 D.发生还原反应的一极
二、选择题(以下每小题均有一个或两个符合题意的答案。每小题3分,共30分)
11.下列物质中,适用于分子晶体的是 ( )
A.熔点1070℃,易溶于水,水溶液导电
B.熔点97.81℃,质软,导电,密度0.97g·cm3
C.熔点10.31℃,液态不导电,水溶液导电
D.能溶于CS2,熔点112.8℃,沸点444.6 ℃
12.已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol
13.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是 ( )
A.金刚石与石墨互为同位素
B.石墨不如金刚石稳定
C.金刚石不如石墨稳定
D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多
14.下列关于铜电极的叙述,正确的是 ( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时精铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
15.关于化学键的各种叙述中,下列说法中正确的是 ( )
A.在离子晶体里,只存在离子键
B.共价化合物里,一定不存在离子键
C.仅由非金属元素形成的化合物中不可能有离子键
D.由不同种元素组成的多原子分子里,一定只存在极性键
16.一定温度和压强下N2+3H2![]() 2NH3反应达到平衡后,下列说法中正确的是 ( )
2NH3反应达到平衡后,下列说法中正确的是 ( )
A.N2与H2不再化合,NH3不再分解
B.N2、H2化合成氨的反应速率等于NH3 分解的反应速率
C.H2、NH3的体积分数相等
D.N2、H2、NH3的物质的量浓度相等
17.100mL6mol·L-1H2SO4与过量Zn粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的 ( )
A.碳酸钠固体 B.水 C.硫酸钾溶液 D.硫酸铵固体
18.在煤矿矿井里,必须采取安全措施,如通风、严禁烟火等,而且要随时检测瓦斯的体积分数,已知空气中甲烷的爆炸极限为5%~15%,氢气的爆炸极限为10%~70%。下列说法中不正确的是 ( )
A.空气中混有可燃性气体遇明火或电火花都有可能引起爆炸
B.空气中混有氢气比混有甲烷的安全隐患更大
C.空气中混有甲烷时,当甲烷与氧气的体积比为1∶2时,爆炸最强烈
D.空气中混有氢气时,当氢气与氧气的体积比为1∶2 时,爆炸最强烈
19.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有 ( )
A.酸性 B.碱性 C.氧化性 D.还原性
20.下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是 ( )
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学反应速率理论可指导怎样提高原料的转化率
C.化学平衡理论可指导怎样使用有限原料多出产品
D.利用化学反应速率和化学平衡理论可提高化工生产的综合经济效益
三、填空或简答(共40分)
21.(6分)写出下列微粒的电子式
(1)H2O (2)Cl- (3)NH4+
22.(14分)W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为 ,X为 ,Y为 , Z为 。
(2)W 2Z的电子式为 。
(3)由Y、X、W组成的物质中含有 键和 键。
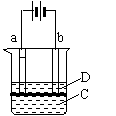 23.(12分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe(OH)2沉淀,两电极材料分别为石墨和铁。
23.(12分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe(OH)2沉淀,两电极材料分别为石墨和铁。
(1)a电极材料应为 ,电极反应式为
(2)电解液C可以是 (填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2
(3)D为苯,其作用是 ,在加入苯
之前对C应作何简单处理
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)
A.该用稀硫酸作电解液 B.适当增大电源电压
C.适当减小两电极间的距离 D.适当降低电解液的温度
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为 。
24.(8分)天然气是一种重要的化石燃料,起主要成分是甲烷。
(1)甲烷分子的空间构型是
(2)甲烷和氯气在光照条件下可以发生取代反应,写出甲烷和氯气发生一取代的反应方程式
(3)1mol甲烷和一定量的氯气反应生成了四种物质的量相等的取代产物。则上述反应中消耗氯气的物质的量是
(4)天然气作为燃料具有热值大、污染小等优点,作为西部大开发的重点工程---西气东输,将为中部和广大长三角地区提供清洁的天然气,如果你家里现在用的液化石油气(主要成分C3H8)改用天然气,你只要将现在家用燃气灶具做适当的改进就可安全使用天然气。你准备采用什么方法来改进?
四、计算题(共10分)
25.丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2 → CH3COCH2I +H+ +I-。 25℃ 时,该反应的速率由下列经验式决定:v=2.73×10-5c(CH3COCH3)c(H+) mol/(L•s)。25℃时,如果c(I2)、c(CH3COCH3)、c(H+)的起始浓度依次是0.01mol/L、0.1mol/L、0.01mol/L,求:
(1)反应开始时的速率是多少?
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
参考答案
一、(每小题2分,共20分)
1.C 2.C 3.B 4.A 5.C 6.B 7.D 8.A 9.D 10.B
二、(每小题3分,共30分;凡多选或错选该题为0分,凡漏选该题的1分)
11.CD 12.B 13.CD 14.C 15.B 16.B 17.BC 18.D 19.D 20.B
|
|
|
|
|
|
22.(每格2分) H
![]() (1)H O Na S
(1)H O Na S
(2)H :S :H
(3)共价 离子
23.
(1)Fe(1分) Fe-2e-=Fe2+(2分)
(2)BC(2分)(多选或错选得0分,漏选得1分)
(3)隔绝空气(2分),加热煮沸,以除去溶解在其中的氧气(1分)
(4)BC(评分标准同本题(2))
(5)白色沉淀颜色逐渐加深,最终变成红
24.(每小题2分,共8分)
(1)正四面体型
光
![]() (2)CH4+Cl2
CH3Cl+HCl
(2)CH4+Cl2
CH3Cl+HCl
(3)2.5mol
(4)增大进气口或减小进风口
四、
解(1)V=2 .73×10-5×0.1×0.01=2.73×10-8mol/(L.s)(2分)
(2) CH3COCH3+I2 → CH3COCH2I +H+ + I-
起始(mol/L): 0.1 0.01 0 0.01 0
碘消耗一半时(mol/L): 0.095 0.005 0.005 0.015 0.005(2分)
V=2 .73×10-5×0.095×0.015=3.89025×10-8 mol/(L.s)(4分)
所以反应速率比开始时快(2分)