第一章 《从实验学化学》单元测验
一、选择题(每题有1~2个正确选项)
1.能够用来鉴别BaCl2 、 NaCl 、 Na2CO3三种物质的试剂是 ( )
A.AgNO3溶液 B.稀硫酸 C.稀盐酸 D.稀硝酸
2.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.2.4g金属镁所含电子数目为0.2NA
B.16g CH4所含原子数目为NA
C.17gNH3所含质子数目为10 NA
D.18g水所含分子数目为18NA
3.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A . 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C . 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
4.在19世纪,化学家对氧化锆的化学式有争议。经测定,锆的相对原子质量为91,其氯化物的相对分子质量是233。若氧化锆中锆的化合价与氯化物中的相同,试判断氧化锆的化学式为 ( )
A.ZrO2 B.Zr2O C.Zr2O3 D.ZrO
5.20℃时,KCl的溶解度为34g,若忽略固体溶解引起的溶液体积变化,则在该温度下,所配KCl溶液中KCl的物质的量浓度不可能是 ( )
A.2mol/L B.3mol/L C.4mol/L D.5mol/L
6.有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。则A的相对分子质量是 ( )
A.29m2/m1 B.29m3/m1
C.29(m3-m1)/(m2-m1) D.29(m2-m1)/(m3-m1)
7.下列说法正确的是 ( )
A.22.4LN2含阿伏加德罗常数个氮分子
B.在标准状况下,22.4L水的质量约为18g
C.22g二氧化碳与标准状况下11.2LHCl含有相同的分子数
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
8.把NaHCO3和Na2CO3·10H2O混和物6.56g溶于水制成100mL溶液,其中
c(Na+)=0.5mol/L。在该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为 ( )
A .2.93 g B.5.85 g C.6.56g D.无法确定
9.粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④ HCl ,加入的先后顺序可以是 ( )
A.①②③④ B.②③①④
C.②①③④ D.③②①④
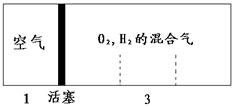
10.如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
A.2:7 B.5:4 C.4:5 D.7:2
11.某种氢气和CO的混合气体,其密度是氧气的一半,则氢气的体积百分含量
为( )
A.40% B.46% C.50% D.54%
12.将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物的质量可能是 ( )
A.2g B.4g C.8g D.10g
13.已知硫酸溶液的质量分数越大时,其溶液的密度越大,将90%和10%的两种H2SO4溶液等体积混合后,溶液的质量分数为 ( )
A.大于50% B.等于50%
C.小于50% D.无法确定
14.已知98%的浓硫酸的浓度为18.4mol.L-1,则49%的硫酸溶液的浓度为
( )
A.9.2 mol.L-1 B.大于 9.2 mol.L-1
C.小于 9.2 mol.L-1 D .无法确定
二、填空题
15.12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是 ,X的相对原子质量是 。
16.VL硫酸铁溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为 。
17.下列所含分子数由多到少的排列顺序是
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃.45gH2O
D.常温下,16gO2,与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
18.化合物A中X的含量为40%,Y的含量为60%,化合物B中X的含量为25%,Y的含量为75%。已知A、B均只由X、Y两元素组成,若A的化学式为XY,则物质的量相同的A和B中所含Y元素的质量之比是 。
19.已知某饱和NaCl溶液的体积为VmL。密度为ρg/cm3,质量分数为w%。物质的量浓度为Cmol/L,溶液中含NaCl的质量为mg。
⑴用m、V表示溶液物质的量浓度 。
⑵用w、ρ表示溶液物质的量浓度 。
⑶用C、ρ表示溶液的质量分数 。
⑷用w表示该温度下NaCl的溶解度 。
三、实验题
20.实验室中固体药品应放在 瓶中,取用时块状固体用 取,粉末状固体用 取。液体药品应放在 瓶中,对于见光容易分解的溶液应放在 色的瓶中。
21.用量筒量取一定体积的液体时,若采用俯视的方法量取20ml液体,则实际量取的液体的体积比20ml ,若量筒中实际有20ml液体,而你读数时采用了俯视的方法,则读得的数据比20ml 。
22.NaOH溶液中主要有Na+、OH-和H2O,在该溶液中滴入酚酞试液呈红色,你通过何种途径证明引起酚酞变色的微粒。
23.实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
⑴实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:
⑵根据计算得知,所需NaOH的质量为 g
⑶下列操作对所配浓度有何影响(填写字母)
偏大的有 ;
偏小的有 ;
无影响的有 。
A、称量用了生锈的砝码;
B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出
E、未洗涤溶解NaOH的烧杯
F、定容时仰视刻度线
G、容量瓶未干燥即用来配制溶液
H、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
四、计算题
24.将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2mol/L、密度为1.20g/cm3的稀硫酸。求:
⑴所需浓硫酸的体积;
⑵所需水的体积
25.在BaCl2溶液中加入一定量的稀硫酸,恰好完全反应,产生的沉淀质量与原稀硫酸溶液的质量相同,则原稀硫酸溶液中溶质的质量分数是多少?
26.含CuSO4和H2SO4的混合溶液200mL,其中CuSO4物质的量浓度为1mol.L-1, H2SO4物质的量浓度为0.5mol.L-1,若用此溶液配成0.2mol.L-1 CuSO4和2mol.L-1 H2SO4的混合溶液,试求:
(1) 所得溶液的体积是多少毫升?
(2) 需加入密度为1.84g.cm-3、98%的浓硫酸多少毫升?
参考答案
1.B 2.C 3.C 4.A 5.D 6.C 7.C 8.A 9.BD 10.CD 11.B 12.BC 13.A 14.C
15.62g/mol、1616.3m/112Vmol/L17. 广口、镊子、药匙、细口、棕 18.小、
大19. 分别以水、氯化钠溶液、氢氧化钾做比较实验。20.CBADE21.1∶2
22.⑴1000m/58.5V mol/L⑵1000wρ/58.5 mol/L⑶(58.5C/10ρ)%⑷
100w/(100-w) g23. ⑴玻璃棒、胶头滴管、量筒。⑵2.0⑶AC、BDEFH、G24.
⑴108.7mL⑵1000mL25. 42% 26.⑴1000mL⑵103.3ml