元素周期律测试题(B)
命题人:陈曼升
注意:试卷总分值:100,考试时间:40分钟。
一、选择题(本题包括12小题,每小题4分,共60分,每小题只有一个正确答案)
1.下列化合物中阴离子半径和阳离子半径之比最大的是
A. LiI B. NaBr C. KCl D. CsF
2.X、Y均为短周期元素,已知aXm+比bYn-少2个电子层,则下列说法正确的是
A. X只能位于第二周期 B. a一定小于b
C. (b-a+m+n)一定等于16 D. Y只能位于第三周期
3.下列叙述正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅦA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.所有主族元素的原子形成单原子离子时的化合价和它的族序数相等
4.1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤–239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤–239的原子核内少54个质子和100个中子,则A元素在元素周期表中的位置是
A.第3周期IA族 B.第4周期IA族
C.第5周期IA族 D.第3周期IIA族
5.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色气体产生,则下列说法正确的是
A.X2+具有强氧化性 B.XCl2溶液呈酸性
C.XO2具有强氧化性 D.该元素是ⅡA族
6.已知a An +, b B( n + 1 )+, c Cn–, d D( n + 1 )–是具有相同的电子层结构的短周期元素形成的简单原 子,下列叙述正确的是
A.原子半径:C > D > A > B B.原子序数:b > a > c > d
C.离子半径:C > D > A > B D.单质还原性:A > B > C > D
7.法国里昂的科学家最近发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
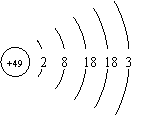 8.张清莲是我国著名的化学家。1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中的首次采用我国测定的原子量值。已知In的原子结构如图所示,则下列关于In的说法不正确的是
8.张清莲是我国著名的化学家。1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中的首次采用我国测定的原子量值。已知In的原子结构如图所示,则下列关于In的说法不正确的是
A.In为长周期元素
B.In为过渡元素
C.In易导电导热
D.In在反应中容易失电子
9.最近,欧洲科学家将62Ni和208Pb经核聚变并释放出1个中子后,生成了第110号元素的一种同位素原子269Uun。 该原子的原子核中的中子数为
A.110 B.159 C.161 D.269
10.如果发现了原子序数为116的元素,下列对它的叙述中正确的是
①位于第7周期 ②非金属元素 ③最外电子层有6个电子 ④没有放射性 ⑤属于氧族元素 ⑥属于锕系元素
A.①③⑤ B.②④⑥ C.①③⑥ D.③④⑤
11.我国的“神舟”五号载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的3 2He,每百吨3 2He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4 2He的形式存在。下列说法正确的是
A. 4 2He原子核内含有4个质子 B.3 2He和4 2He互为同位素
C.4 2He原子核内含有3个中子 D.4 2He的最外层电子数为2,所以4 2He具有较强的金属性。
12.下列分子中所有原子都满足最外层8电子结构的是
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
二、填空题(4小题共33分)
13.(10分) A、B、C、D是20号以内的四种元素,其原子序数依次增大。C和D可形成化合物X,A和B可形成化合物Y,将少量X和过量Y一起放入水中,可放出一种无色无味的气体,同时得到一种无色澄清的溶液。向此溶液中滴加过量X的水溶液时,可生成一种白色胶状沉淀物Z(Z与Y的相对原子质量相等)。过滤后得到一种无色澄清溶液,其中含G,G的焰色呈黄色,向G的水溶液中加入酸化的硝酸银溶液时,能生成一种白色沉淀。根据以上推断:
(1)A是 ,B是 ,C是 ,D是 。
(2)X的分子式是 ,Y的化学式是 。
(3)4 mol X与6 mol Y在水溶液中发生反应的化学方程式是 。
(4)生成白色胶状沉淀物Z的离子方程式是: 。
14.(10分)写出下列反应的化学方程式
(1)铝和稀盐酸反应
(2)氯化铝溶液和适量烧碱溶液反应生成氢氧化铝
(3)氢氧化铝和烧碱溶液反应
(4)氢氧化铝和稀盐酸反应
(5)SiO2与NaOH溶液反应
15.(6分)已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C=4:2:3。请回答下列问题:
(1)写出B的原子结构示意图 ,写出C和D形成的淡黄色固体化合物的电子式 。
(2)元素原子的物质的量之比为A:B:C=4:2:3 的晶体名称为 。
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例) 、 。
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式 。
16.(7分)致冷剂是一种易被压缩、液化气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃烧。于是科学家根据元素性质的递变规律来开发新的致冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
⑴氢化物的易燃性:第二周期: >_____>H2O>HF;第三周期:SiH4>PH3>H2S>HCl。
⑵化合物的毒性:PH3>NH3;H2S___H2O;CS2___CO2;CCl4>CF4
于是科学家们开始把注意力集中在含F、Cl的化合物上。
⑶已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新的致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其他类似的还可以是______________
⑷然而,这种致冷剂造成了当今的某一环境问题是_________,但求助于周期表中元素及化合物的__________________(填写字母)变化趋势来开发致冷剂的科学思维方法是值得借鉴的。①毒性 ②沸 点 ③易燃性 ④水溶性 ⑤颜色
三、计算题(7分)
17.元素R的气态氢化物的化学式为HXR。在标准状况下,8.5 g HXR气体的体积是5.6 L。将5.1g HxR气体通入200mL、0.75mol/L 的CuCl2 溶液正好完全反应(非氧化还原反应)。
(1)求HXR的式量。
(2)推断x值,并确定R的元素符号。
元素周期律测试题(B)参考答案:
1、A 2、B 3、C 4、C 5、C 6、B 7、C 8、B 9、B 10、A 11、B 12、A
13、(1)O Na Al Cl (2) AlCl3 Na2O2
(3)4AlCl3 + 6Na2O2 + 6H2O = 4Al(OH)3↓ + 12NaOH + 3O2↑
(4)Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓
14.(1)2Al+6HCl=2AlCl3+3H2↑. (2)AlCl3+3NaOH=Al(OH)3↓+3NaCl.
(3)Al(OH)3+NaOH=NaAlO2+2H2O. (4)Al(OH)3+3HCl=AlCl3+3H2O
(5)2NaOH+SiO2=Na2SiO3+H2O
![]() 15、(1)
15、(1)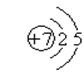
 (2)硝酸铵
(2)硝酸铵
(3)OH — NH4+ (4)N2O3
16.(1)CH4>NH3,H2S>HCl
(2)>,>
(3)CFCl3(或CF3Cl)
(4)使大气臭氧层出现空洞 123
17.34、2、S