高一化学上学期11月份月考试题
化 学
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 P-31 S-32 Cl-35.5 Cu-64 Ba-13
I卷(选择部分)
一、选择题(每小题有1-2个选项符合题意,共45分)
1.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大
小的金属钠,可能观察到的现象是 ( )
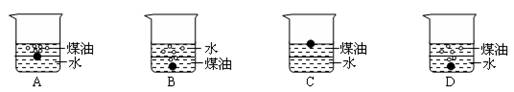
2.少量的金属钠长期暴露在空气中,它的最终产物是
A.NaOH B.Na2CO3•10H2O C.Na2CO3 D.NaHCO3
3.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在下列使用场合中,必须加以控制的是 ( )A.制铝合金门窗 B.制牙膏皮 C.制防锈油漆 D.炼铝厂制造铝锭
4.下面有关Na2CO3 与NaHCO3的叙述错误的是 ( )
A.相同浓度溶液的碱性:Na2CO3比NaHCO3强
B.在水中的溶解度:Na2CO3比NaHCO3大
C.与同浓度的硫酸反应时,Na2CO3比NaHCO3剧烈
D.NaHCO3能与NaOH反应,而Na2CO3不能
5.下列反应的离子方程式书写正确的是 ( )
A.钠和冷水反应: Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2
C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
D.铜和硝酸银溶液反应: Cu + 2Ag+ = 2Ag + Cu2+
6.硫酸亚铁溶液中含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入
下列哪种物质 ( )
A.锌粉 B.铁粉 C.镁粉 D. 铝粉
7.用铝箔包着2.3g金属钠,放入50ml水中,放出的H2体积(标准状况)是
A.等于2.24L B.等于1.12L C.大于1.12L D.小于1.12L
8.金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说
明金属钠具有的性质是:① 密度较小 ②熔点较低 ③ 硬度较小 ( )
④还原性强 ⑤ 该反应生成相应的碱 ⑥ 该反应是放热反应
A.①②③④⑤ B.①②④⑤⑥ C.除③⑥之外 D.全部
9.将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能
有 ( )
A.Cu、Fe3+ B.Fe2+、Fe3+ C.Cu、Cu2+、Fe D.Cu、Fe2+、Fe
10.足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积
在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为 ( )
A.1︰2 B.3︰2 C.3︰1 D.1︰1
11.将Na2O2投入FeCl2溶液中, 可观察到的现象是 ( )
A.生成白色沉淀.有气泡产生 B.生成红褐色沉淀.有气泡产生
C.生成浅绿色沉淀.有气泡产生 D.生成黑色沉淀,有气泡产生
12.下列各组离子能在水溶液中能大量共存的是 ( )
A.Fe3+.SCN-.Cl-.K+ B.Al3+.SO42-.Na+.OH-
C. AlO2-.Na+.OH-.K+ D.HCO3-.OH-.Na+.K+
13.钡和钠相似,也能形成含![]() 的过氧化物,下列叙述中正确的是 ( )
的过氧化物,下列叙述中正确的是 ( )
A.过氧化钡的化学式为Ba2O2
![]() B.
B.![]() 的电子式为:[ ]2-
的电子式为:[ ]2-
C.反应NaO2+2HCl==2NaCl+H2O2为氧化还原反应
D.过氧化钡和过氧化钠都具有强氧化性
14.下表中,对陈述Ⅰ.Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于制疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ错,无 |
| D | 过氧化钠可用于航天员的供氧 | Na2O2能和CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
15.往100ml 0.1mol/L 的Al2(SO4)3溶液中加入 0.5mol/L的NaOH溶液,得到1.17克沉淀,则加入的NaOH溶液的体积是 ( )
A.70ml B.90ml C.130ml D.160ml
Ⅱ卷(非选择题部分)
二、填空题
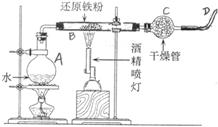 16.(10分)右图是铁粉和水蒸气反应的
16.(10分)右图是铁粉和水蒸气反应的
实验装置示意图
(1)写出该反应的化学方程式
(2)实验中,D处排出的气体几乎点不着,
已知该装置不漏气,使用的各种药品没
有质量问题,你认为气体点不着的可能
原因是: ,
改正的措施是: 。
(3)有人建议将烧瓶中的水改用纯碱晶体(NaCO3•10H2O),你认为是否可行?
,理由是 。
17.(13分)2004年2月3日,美国“机遇”号火星车向地球传回了火星土壤的显微照片,
显示的是“机遇”号火星车的着陆区域——“梅里迪亚尼平面”,从照片上可以看出该地为红色和桔色(两种颜色近乎红棕色),所以可能存在赤铁矿(主要成分是Fe2O3)。试回答下列问题。
(1)人们从“机遇”号火星车所发回的实物照片的红色和桔色,来推断火星上可能存在着赤铁矿,这是利用了物质的颜色这一_________性质对物质的存在进行推测的。如果要进一步确定这种推测是否正确,必须通过实验验证。
(2)假设有一块火星矿物样品,请同学们用学过的知识设计化学实验来证明该火星矿物中是否有三价铁元素。
实验原理: 。
实验用品:锤头.研钵(研杵).烧杯.玻璃棒.漏斗.铁架台.滤纸.试管.滴管.稀盐酸.KSCN溶液
实验步骤及方法:①
②
③
④
实验结果分析及结论:
三、填空题(本题包括2小题,共17分)
18.(9分)(1)鉴别KCl溶液和K2CO3的试剂是 ,离子方程式
为
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式
为
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式
为
19.(8分)已知有以下物质相互转化
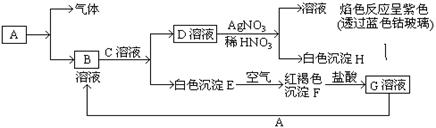
试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的离子方程式 ; 向G溶液加入A的有关离子反应方程式 _______。
四、计算题(本题包括2小题,共15分)
20.(8分)过氧化钠与铝粉混合物共18.3g,加入100ml 水,充分反应后混合物完全溶解,并收集到5.6L气体(标准状况)
(1)收集到的气体成份是 ,体积比是 。
(2)计算反应后溶液中各溶质的物质的量浓度(该溶液体积不变)
21.(7分)将6 g的铁粉加入200 mLFe2(SO4)3和CuSO4的混合溶液, 充分反应得到200 mL. 0.5mol /LFeSO4溶液和5.2 g固体沉淀物。请计算
(1)反应后生成铜的质量; (2)原Fe2(SO4)3溶液的物质的量浓度。
参考答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | C | B | C | D | B | C | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 | D | B | B | C | D | D | BC |
16.(1)3Fe + 4H2O(g) == Fe3O4 + 4H2(2)可能的原因:① 产生的H2太少,② 水蒸气过多
改正措施:① 增加还原铁粉的用量 ② 控制烧瓶加热温度,避免产生大量的水蒸气。
(或增加干燥剂用量) (每空2分)
(3)可行。Na2CO3•10H2O受热产生平稳的水蒸气流,也能避免产生大量水蒸气。
17.(1)物理;(1分);(2)实验原理:Fe2O3+6H+=2Fe3++3H2O ,Fe3+遇到KSCN溶液变为红色。实验步骤及方法:
①样品处理:将样品用锤头敲碎,放置在研钵中研细备用。②溶解:将研磨好的样品粉
末倒入烧杯,加10mL稀盐酸,用玻璃棒搅拌片刻。③过滤:取②中混合物液体过滤。
④检验:取2mL滤液加入到试管中,然后向试管中滴加2滴KSCN溶液。观察溶液的
颜色变化。
验结果分析及结论:若溶液变为红色,则原火星矿物样品中含有三价铁元素;如果溶液不变色,则原火星矿物样品中不含三价铁元素。 (每空2分)
18.(1)盐酸.CO32-+2H+=CO2↑+H2O;(2)盐酸.HCO3-+H+=CO2↑+H2O;
(3)加热:2NaHCO3![]() Na2CO3+CO2↑+H2O (每小题3分)
Na2CO3+CO2↑+H2O (每小题3分)
19.(1)FeCl2 KCl (各1分) (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe3++SCN-=Fe(SCN)2+ 2Fe3++Fe=3Fe2+ (每个方程式2分)
20.(1)O2和H2 2∶3
(2)c(NaOH)= 3 mol/L c(NaAlO2)= 1 mol/L (每小题4分)
21. 2.56g、(3分);0.3mol/L (4分)