高一化学上学期期末测试题2
化 学
YCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至3页(第1至20题),第Ⅱ卷4至6页(第21至26题),共100分,考试时间90分钟。
第Ⅰ卷(选择题 共40分)
注意事项:
1、 答第Ⅰ卷前,考生务必将本人的学校、班级、姓名、考试号填在第Ⅱ卷的密封线内。
2、 将第Ⅰ卷上每小题所选答案前的字母标号填写在第Ⅱ卷卷首相应的答题栏内。在第Ⅰ卷上答题无效。
3、 考试结束后将试卷交回。
可能用到的相对原子质量:
H:1 N:14 O:16 S:32 Cl: 35.5 Na: 23 Al: 27 Fe: 56 Cu: 64
一、选择题(每小题只有一个选项符合题意,每小题2分,共20分)
1.近年来,华东地区一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞。大雾属于下列分散系中的 ( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
2.下列物质中,能够导电的电解质是 ( )
A.熔融的MgCl2 B.Cu丝 C.NaCl溶液 D.蔗糖
3.向浓盐酸中滴加浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因是
( )
A.浓H2SO4具有脱水性 B.浓H2SO4具有吸水性
C.盐酸具有挥发性 D.气体溶质的溶解度随温度升高而降低
4.进行下列实验肯定能获得成功的是 ( )
A.用1mol·L-1的盐酸与MnO2反应制取氯气
B.用湿润的淀粉碘化钾试纸鉴别二氧化氮和溴蒸气
C.用10mL量筒准确量取8.50 mL稀硫酸
D.用热的浓纯碱溶液去除管壁内壁附着的油脂
5.用氯气消毒自来水配制下列溶液时,会导致药品明显变质的是 ( )
A.Na2SO4 B.AgNO3 C.NaCl D.AlCl3
6.下列化学反应中,硝酸只表现氧化性的是 ( )
A.3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
B.CuO+2HNO3 (稀)=Cu(NO3) 2 +H2O
C.C+4HNO3 (浓)=CO2 ↑+4NO2↑+2H2O
D.3Ag+4HNO3 (稀)=3 AgNO3 +NO↑ +2H2O
7.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是 ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显现象的是小苏打
C.等质量的碳酸钠和碳酸氢钠分别与足量的食醋反应,前者产生二氧化碳少
D.先将两样品配成溶液,后分别加入石灰水,无白色沉淀生成的是小苏打
8.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关
于NO的说法不正确的是 ( )
A.NO为无色气体 B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
9.下列物质中,不能由Fe跟非金属单质直接化合而成的是 ( )
A.Fe3O4 B.FeS C.FeCl3 D.FeCl2
10.环境保护是我国的一项基本国策。污染已成为人类社会面临的重大威胁,下列各词与环境污染无关的是①温室效应②赤潮③酸雨④光化学烟雾⑤臭氧空洞⑥水俣病⑦潮汐⑧大脖子病⑨水华 ( )
A.⑦⑧ B.⑥⑦⑧ C.②⑨ D.②⑤⑦
二、选择题(本题包括10小题,每小题2分,共20分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分)
11.在试管的内壁附着下列物质,用稀盐酸浸泡而不能除去的是 ( )
A.用足量一氧化碳还原氧化铁后留下的物质
B.用足量氢气还原氧化铜后留下的红色物质
C.盛石灰水后留下的白色固体
D.硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体
12.对危险化学品要在包装标签上印有警示性标志,硝酸应选用的标志是 ( )




A. B. C. D.
13.无色透明的酸性溶液中能大量共存离子组是 ( )
A.NH4+、Al3+、SO42-、NO3- B.K+、Na+、NO3-、SO32-
C.K+、MnO4-、NH4+、NO3- D.Na+、K+、Mg2+、SO42-
14.下列离子方程式书写正确的是 ( )
A.铁粉投入到盐酸中:2Fe+6H+=2Fe3++3H2↑
B.Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O
C.漂白粉溶液中通入过量的CO2:Ca2++2ClO-+ CO2+ H2O = CaCO3↓+2HclO
D.硫酸与Ba(OH)2溶液反应: H++OH-=H2O
15.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O ,与该反应在氧化还原反应原理上最相似的是 .. ( )
A.2NaBr+Cl2=2CaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.C+CO2![]() 2CO
D.2H2S+SO2=2H2O+3S↓
2CO
D.2H2S+SO2=2H2O+3S↓
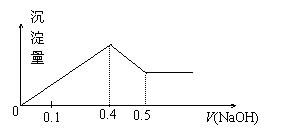 16.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
16.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )
A.1:3 B.2:3
C.6:1 D.3:1
17.工业废气中氮氧化物是主要的大气污染源之一。已知2NO2+2NaOH=NaNO3+NaNO2+H2O,
NO2+NO+2NaOH=2NaNO2+H2O。现有a mol NO2和b mol NO的混合气,若用足量的
NaOH溶液将其完全吸收,则混合气中两种气体的物质的量必须满足的关系是 ( )
A.a=b/3 B.2a=b C.a≥b D.a<b
18.用加热的方法可分离下列物质的是 ( )
A.碘和食盐 B.氯化铵和氯化钡
C.氯化铵和消石灰 D.碳铵和过氧化钠
19.阿伏加德罗常数的值约为6.02×1023 mol-1,下列叙述中错误的是: ( )
A.标准状况下,2.24L的N2与O2的混合气体中所含分子总数为0.1×6.02×1023
B.1mol CH3+(碳正离子)中含有的电子数为8×6.02×1023
C.1L0.2mol/L的KClO3溶液中所含氯离子的数目为0.1 ×6.02×1023
D.在2H2S+SO2==3S+2H2O反应中,当有32g还原产物生成时,转移电子为2 ×6.02×1023
20.向一定量的 FeO、Fe、Fe3O4 Fe2O3的混合物中加入200ml1mol·L-1的盐酸,恰好使混合物完全溶解,放出224ml(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量是( )
A.11.2g B.5.6g C.2.8g D.无法计算
三、实验题(本题包括2小题,共23分)
21.(共13分)
(1)在生产、生活和科学实验中经常需要进行混合物的分离。以下实验中应选择下列哪种分离方法?(填写序号)①纸上层析 ②过滤 ③萃取 ④蒸发结晶 ⑤蒸馏
a.海水淡化
b.用海水晒盐
c.从溴水中提取溴
d.分离豆浆和豆渣
e.实验室分离墨水中的染料可用
(2)范老师在课堂上演示了如下实验:她在试管中加入2 mL 0.2 mol·L-1的CuSO4溶液,再加入3 mL 0.2 mol·L-1的NaOH溶液,恰好反应。结果得到的沉淀并不是蓝色的,而是浅绿色的;她请同学们思考这是为什么? 小英同学通过查找资料得知,该浅绿色沉淀物可能是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4。
①请帮小英同学写出生成浅绿色沉淀的化学反应方程式
________________________________________________。
②请帮小英同学设计一个简单实验,证明Cu4(OH)6SO4中含有硫酸根离子。
_____________________________________________________________________
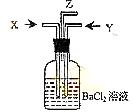 (3)已知二氧化硫能被稀硝酸氧化。现将碳跟浓硫酸共热产生
(3)已知二氧化硫能被稀硝酸氧化。现将碳跟浓硫酸共热产生
的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足
量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中沉淀的化
学式为 ;在
Z导管口观察到的现象是
22.(10分)某学生拟用下图装置组装成一套装置验证过量的锌与浓硫酸反应的产物,试回答下列问题:
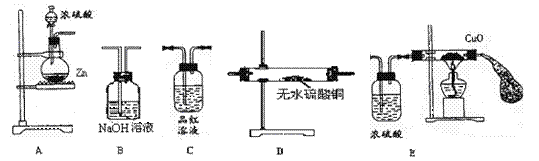 (1)这些装置连接的正确顺序是(填A.B.C.D.E):
(1)这些装置连接的正确顺序是(填A.B.C.D.E):
A ——→D——→ ——→ ——→
(2)实验中观察到C中的现象为 ,结论是 ;D中的现象为 ,结论是 ;
(3)B中反应的化学反应方程式为 ;
(4)反应一段时间后可观察到E中玻璃管中的黑色固体变为紫红色,由此可证明产物中有 ,试解释反应初始阶段未观察到此现象的原因:
。
四、填空题(本题包括2小题,共23分)
23.(18分)(1)地壳中某主要元素是现代许多高科技产品的重要组成元素之一,足见化学对现代物质文明起作重要的推动作用。请根据你的所见所闻填写以下空白:
①光导纤维的主要成分 (填写化学式)
②目前应用最多的太阳能电池的光电转化材料是 (填写名称)
③神奇无比的集成电路芯片的主要成分 (填写名称)
④用作吸附剂、催化剂的载体的人造分子筛大多是一类为 (填写名称)
⑤写出工业上以某矿物为原料制备该元素的高纯度单质的化学方程式
(2)下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从A-E中选择各题要求的序号填入表中
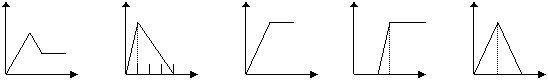 |
A B C D E
| 溶液 | 加入的物质 | 答案序号 |
| MgCl2 和AlCl3的混和液 | 滴加NaOH至过量 | |
| NaAlO2溶液 | 滴加稀HCl至过量 | |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | |
| AlCl3溶液 | 通过量的NH3 | |
| 饱和石灰水 | 通CO2至过量 |
(3)类比思维是化学研究中常用的思维方法,它能帮助研究人员从一个问题出发来巧妙地解决一类本质相似的问题。已知:过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:Na2O2+CO=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2 。
试回答下列问题:
①写出Na2O2分别与SO2、SO3反应的化学方程式:
。
。
②请你总结归纳出过氧化钠与常见气态非金属氧化物发生反应的规律:
24.(5分)已知:I-、Fe2+、Br-离子还原能力的强弱顺序为:I->Fe2+>Br-。现有含FeI2、FeBr2各0. 1 mol的混合溶液200 mL,向其中缓慢地通入氯气(假定Cl2分子只与溶质离子反应,不考虑其它反应):
(1)若有0. 1 mol Cl2被还原,则所得溶液中含有的主要阴离子为: ;
(2)若原溶液中Br- 有一半被氧化,共消耗Cl2的质量为 g;将反应后的溶液加水稀释至400mL,其中主要的阳离子是 ,其物质的量浓度为 。
(3)试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序为: 。
五、计算题(本题包括2小题,共14分)
25.(5分)把1摩尔钠和1摩尔铝的混合物小心地投入954克水中,充分反应后溶液的质量分数为多少?
26.(9分)请关注硝酸在反应中的动态变化:在盛放浓硝酸的试管中放入过量的铜片,回答下列问题:
(1)反应开始时的实验现象为
反应的化学方程式为
(2)临近结束时的反应离子方程式为
(3)待反应停止后,再加入少量10%的硫酸,现象为
原因是
(4)若将25.6 g Cu跟一定量的浓硝酸反应,铜消耗完时,共产生11.2 L (STP)气体。则所消耗的HNO3物质的量为多少?所得气体的质量为多少?
答案及评分标准
说明:1、文字简答题以关键词到位为准,按点给分;
2、方程式书写:(1)没配平得0分;(2)化学式书写错误得0分;
(3)条件、沉淀号等若分值为1分的不扣分,若分值为2分的扣1分。
3、写名称或化学式正确的正常给分;
4、其他合理解法正常给分。
一、选择题(每小题2分,共20分)
1.D 2.A 3.A 4.D 5.B 6.C 7.C 8.D 9.D 10.A
二、选择题(每小题2分,共20分;错选得0分,漏选得1分)
11.B 12.B D 13. AD 14.B 15. D 16.C 17.C 18.AB 19.CD 20.B
三、实验题(本题包括2小题,共23分)
21.(13分)(1)a.⑤ b.④ c.③ d.② e.① 每空1分
(2)①4CuSO4+6NaOH=Cu4(OH)6SO4 ↓+3Na2SO4 (2分)
②取少量的绿色固体溶于足量的稀盐酸中,再滴加几滴BaCl2溶液,若有白色沉淀,则含有SO42-;反之,则无SO42-。(2分)
(3)BaSO4;(2分)有红棕色气体产生;(2分)
22.(10分)(1)C.B.E(2分)
(2)品红溶液褪色,(1分)有SO2生成(1分);无水硫酸铜变蓝(1分),有水生成(1分);
(3)SO2+2NaOH=Na2SO3+H2O(2分);
(4)有H2生成(1分);实验初始阶段硫酸为浓的,有强氧化性,Zn将其中+6价S还原为+4价的SO2(1分)
四、填空题(本题包括2小题,共23分)
23.(18分
![]()
![]()
![]() (1)①SiO2;②硅;③硅;④铝硅酸盐;⑤SiO2+C Si+2CO↑、Si+2Cl2
(1)①SiO2;②硅;③硅;④铝硅酸盐;⑤SiO2+C Si+2CO↑、Si+2Cl2
SiCl4、SiCl4+2H2 Si+4HCl(每空1分,共7分)
(2)A.B.D.C.E(每空1分,共5分)
(3)① Na2O2+SO2= Na2SO4、2Na2O2+2SO3=2 Na2SO4 + O2 (各2分)
②A.高价氧化物与过氧化钠反应生成高价的钠盐和氧气;
B.低价氧化物与过氧化钠反应仅生成高价的钠盐,无氧气产生;(各1分)
24.(1)Cl-、Br-;(2)17.75g;Fe3+;0.5mol·L-1(3)Cl2>Br2>Fe3+>I2 (每空1分)
五、计算题(本题包括2小题,共15分)
25.写出正确方程式给2分;偏铝酸钠质量(82g)给1分;答案正确(8.2%)给2分;。
26.(9分)
(1)铜片溶解,有红棕色气体产生;(给1分,溶液颜色写或不写都不算分)
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(1分)
(2)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(1分)
(3)铜片继续溶解,管内有无色气体产生,管口呈红棕色;(1分)
硫酸提供的H+与溶液中的NO3-形成硝酸继续溶解铜;(1分)
(4)硝酸的物质的量为:13mol(2分)
NO质量为:4.5g,NO2质量为:16.1g(各1分)或气体的总质量为:20.6g(2分)