高一化学上学期期中测试题2
化 学
考试时间100分钟,满分100分
第I卷(46分)
本卷可能用到的相对原子质量:C:12 H:1 N:14 Cu:64 O:16 Fe:56 S:32
Si:28 Na:23 Mg:24 Ne:20 Ba:137 K:39 Mn:55 Cl:35.5
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶
叶”、“含 氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为: ( )
A.元素 B.单质 C.分子 D.氧化物
2.下列有关原子的说法正确的是: ①原子是化学变化中的最小微粒;②原子不能再分;
③原子在化学变化中不能再分;④原子在化学变化中 不发生变化;⑤原子核在化学变
化中不发生变化。 ( )
A.①②③ B.①③④ C.①②⑤ D.①③⑤
3.具有相同质子数的微粒一定是: ( )
A.同一种原子 B.同一种元素 C.同一种分子 D.无法确定
4.物质的量相同的甲烷(CH4)和氨气(NH3),一定相同的物理量是: ( )
A.质量 B.体积 C.质子数 D.原子数
5.质子数和中子数相同的原子A,其阳离子An+核外共有X个 电子,则A的质量数为:
( )
A.2(x+n) B.2(x-n) C.2x D.n+2
6.在某化学反应中,铜离子得到2.408×1023 个电子,则可得到铜单质: ( )
A.25.6g B.32g C.12.8g D.38.4g
7.下列各组中的物质都是电解质的是: ( )
A.H2O、NH3·H2O、HNO3、CH3CH2OH B.HCl、NaBr、SO3、Na3PO4
C.CuSO4、NaOH、BaSO4、CH3COOH D.NH3、Na2CO3、BaSO4、NaI
8.金属钠分别投入下列溶液中,既有白色沉淀产生又有气体放出的是: ( )
A.MgCl2溶液 B.K2SO4溶液 C.FeCl3溶液 D.NH4NO3溶液
二、选择题(每小题可能有一~二个选项符合题意,每小题3分,共30分)
9.下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是: ( )
A.实验室中用稀硫酸与锌粒反应制取 H2 ;
B.实验室中用高锰酸钾加热分解制取 O2 ;
C.实验室中用浓盐酸与二氧化锰加热制取Cl2 ;
D.实验室中用稀盐酸与石灰石反应制取CO2 。
10.下列有关氯水的叙述,正确的是: ( )
A.新制氯水只含有氯气和次氯酸分子;
B.新制氯水可使紫色石蕊试液先变红后褪色;
C.氯水光照时有气泡逸出,该气体的主要成分是氯气;
D.氯水放置数天后,其酸性逐渐增强。
11.下列说法中正确的是: ( )
A.在氧化还原反应中,一定是一种元素被氧化,另一种元素被还原;
B.在氧化还原反应中,不一定所有元素的化合价都发生改变;
C.氧化还原反应的实质是反应中原子发生了重新组合;
D.某元素由化合态转化为游离态,这种元素一定被还原了。
12.下列有关碳酸钠和碳酸氢钠的说法不正确的是: ( )
A.在水中的溶解度:碳酸钠>碳酸氢钠;
B.热稳定性:碳酸钠>碳酸氢钠;
C.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少;
D.足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生二氧化碳一样多。
13.用NA表示阿伏加德罗常数,下列说法中正确的有: ( )
A.2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA ;
B.1L1mol/L的CaCl2溶液中含Cl-的数目为NA ;
C.在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA ;
D.标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子。
14.如图所示,下列实验操作与方法正确的是: ( )
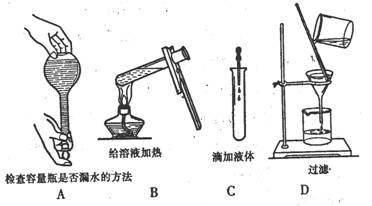 |
15.下列数量的物质中含原子个数最多的是: ( )
A.0.4mol氧气 B.4℃时5.4mLH2O
C.标况下5.6L二氧化碳 D.10 g氖
16.某学生只有下列仪器和用具:烧杯、试管、量筒、铁架台(带铁夹)、酒精灯、集气瓶、玻璃片、水槽、导气管、橡皮塞、橡皮管、100mL容量瓶、玻璃棒、药匙、火柴。从缺少仪器或用品的角度看,该学生不能进行的实验操作是: ( )
A.制取氢气
B.粗盐提纯
C.用氢气还原氧化铜
D.用氯化钠晶体配制100mL0.1mol·L—1的氯化钠溶液。
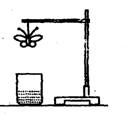
17.某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是:( )
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧杯中的溶液 | 浓盐酸 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
18.将等质量的① Na ② Na2O ③ Na2O2 ④ NaOH ⑤ Na2CO3·10H2O露置于空气中,最后质量由小到大的顺序是: ( )
A.⑤<④<③<②<① B.①<②<③<④<⑤
C.⑤<④<②=③<① D.⑤<③<④<②<①
第Ⅱ卷(54 分)
三、填空题
19.(12分)(1)1mol H2SO4中含______mol硫原子, ____个氧原子,_____个氢原子。
(2)4.5g水与_________g硫酸所含的分子数相等,它们所含氧原子数之比是_______,氢原子数之比是_________。
20.(8分)以不同的分类标准,可以把某些物质分入不同的类别进行研究,是化学研究中的一种常用的重要方法。如氯化氢这种物质在不同的分类标准下可以分别划入气体、无氧酸、易溶物、氯化物、氢化物、电解质等若干类物质中。
现有氢氧化钠、氧气、氧化铜、盐酸四种物质,请设计出4种分类标准,使其得到这样的分类结果:其中一种物质单独属于一类,其余三种物质均不属于这一类,将结果填人下表中:
| 序号 | 分类标准 | 单独属于一类的物质名称 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 |
21.(4分)自然界中的物质多数是以混合物的形式存在,下面是混合物的分离和提纯要求,请填空:
(1)除去KNO3固体中混有的少量NaCl,所进行的实验操作依次为:_________、加热、冷却、结晶、_________。
(2)除去KCl溶液中的SO42-离子,须依次加入的溶液为(填溶质的化学式):
22.(6分)已知反应:2H2CrO4 + 3H2O2 = 2Cr(OH)3 + 3O2 ↑+ 2H2O 该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是 →
(3)在反应方程式中标明电子转移的方向和数目(单线桥)
(4)如反应中转移了0.3mol电子,则产生的气体在标准状况下体积为
四、实验探究题
23.(6分)海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里欲从海带中提取碘。(已知Cl2 + 2KI = 2KCl + I2)
(1)指出提取碘的过程中有关的实验操作名称:①___________;②___________
(2)提取碘的过程中可供选择的有机溶剂是( )
A.苯、酒精 B.CCl4、苯 C.汽油、乙酸
(3)为使海带灰中的碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,仍缺少的玻璃仪器是__________。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏过程(为防止碘升华,本实验中采用水浴加热)。指出下图所示的蒸馏装置中的错误:
①_________________________________,
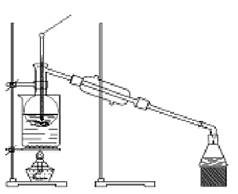 ②____________________________ __
②____________________________ __
24.(6分)已知某纯碱(Na2CO3)试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
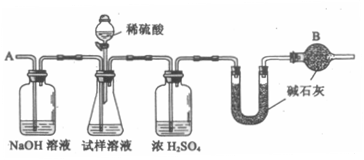
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将a g试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的U型管的质量,得到b g;
④从分液漏斗滴人6 mol·L-1 的硫酸,直到不再产生气体时为止;
⑤从导管A处缓缓鼓人一定量的空气;
⑥再次称量盛有碱石灰的U型管的质量,得到c g;
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g;
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
五、计算题
25.(6分)用KMnO4与足量浓度为12mol/L的浓盐酸反应.反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
回答下列问题:
(1) 15.8g KMnO4能氧化的HCl物质的量为多少?
(2) 产生的Cl 2在标准状况下的体积为多少?
26.(6分)取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:[第(3)问请写出计算过程]
(1)原混合液中Na2SO4的物质的量浓度为________ __ mol ·L-1;
(2)产生的气体在标准状况下的体积为_______ __L;
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应前后溶液的密度均为
1g·cm-3,反应前后溶液体积变化忽略不计)。
六、附加题
 27.(10分)资料:氨(NH3)是一种没有颜色,有刺激性气味的气体,极易溶解于水且溶解得很快,在常温下,1体积水大约可溶解700体积氨气。氨的水溶液叫做氨水。氨水有弱碱性,能使酚酞溶液变红或使湿润的红色石蕊试纸变蓝。
27.(10分)资料:氨(NH3)是一种没有颜色,有刺激性气味的气体,极易溶解于水且溶解得很快,在常温下,1体积水大约可溶解700体积氨气。氨的水溶液叫做氨水。氨水有弱碱性,能使酚酞溶液变红或使湿润的红色石蕊试纸变蓝。
请依据上述资料中提供的相关信息完成本题。
某同学通过以下实验探究喷泉实验的原理。
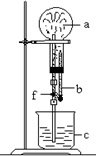
(1)按图示装置进行氨的喷泉实验。(图中a为充满氨气的圆底
烧瓶;b为固定在橡皮塞上内装有少量水的滴管;c为酚酞溶液;
f为止水夹,该止水夹夹在连接有上下两段玻璃管的胶管上,上段
玻璃管固定在橡皮塞上且伸入烧瓶内,下段玻璃管伸进酚酞溶液中)
请说明应如何引发喷泉。
。
(2)该同学做实验时,发现烧杯中只有少量液体通过玻璃管缓缓进入烧瓶,并未形成喷泉,请分析导致实验失败的可能原因。(可不填满,也可补充)
①
②
③
(3)该同学依据上述喷泉实验的原理,更换了实验药品,在上图装置中的烧瓶中充满干燥气体a ,滴管中装有液体b ,按上述操作引发喷泉,烧杯中的液体c最终几乎充满烧瓶(b和c相同)。则a和b分别是 (填写相应的序号)。
|
| a(干燥气体) | b或c(液体) |
| ① | 空气 | 水 |
| ② | CO2 | 4mol/LNaOH溶液 |
| ③ | Cl2 | 饱和NaCl溶液 |
| ④ | NH3 | 1mol/LHCl溶液 |
参考答案
一、选择题(46分)
1.A 2.D 3.D 4.C 5.A 6.C 7.C 8.A 9.D 10.BD 11.B 12.D 13.AC 14.A 15.B 16.BD 17.AB 18.A
二、填空题
19.(12分)(1)__1___;2.408×1024_;1.204×1024_ (2)_24.5_ 1∶4 1∶1
20.(8分)可据常温下的状态、颜色、是否纯净物、元素种类、酸性、碱性等分类,只要合理,每种分类法可得2分,最多得8分。
21.(4分)(1)溶解 ;过滤 (2)BaCl2 KCO3 HCl
22.(6分)(1)H2O2 (2)H2CrO4 Cr(OH)3
(3)2H2CrO4 + 3H2O2 = 2Cr(OH)3 + 3O2 + 2H2O
(4)3.36 L
四、实验探究题
23.(6’)(1)过滤,萃取 (2)B (3)分液漏斗 (4)温度计插入液体中,冷凝管进出水的方向颠倒
24.(6分)(1)样品重,砝码轻 (2)防止空气中的CO2和水气进入U型管中
(3)偏高 (4)把反应产生的CO2全部导入U型管中
(5)判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收
(6)![]()
五、计算题
25.(6分)(1) 0.5mol (2) 5.6L
26.(6分,每小题2分)(1)0.2 (2)1.12
(3)所得滤液溶质为NaOH。根据Na元素守恒得
n(NaOH)=2×[n(Na2SO4)+n(Na2CO3)]
=2×[![]() ]=0.14mol 1分
]=0.14mol 1分
故 c(NaOH)=![]() =0.7mol/L
1分
=0.7mol/L
1分
六、附加题(10分)
(1)挤压胶头滴管的胶头,使滴管中的液体进入烧瓶,然后可轻轻摇动烧瓶,打开止水夹,烧杯中的液体就会喷入烧瓶。(也可先打开止水夹,然后再挤压胶头)。(3分)
(2)①烧瓶内氨气收集得不满(或只收集了很少的氨气)②烧瓶内壁不干燥,氨气溶解混入了空气③装置漏气,氨气溶解的过程中空气进入,不能形成喷泉。(只要回答出其中的两点,即得4分)。
(3)②④(选对其中的一项得1分,两项都对得3分,但选错一项就只得0分)