高一化学第一学期期末高中学业评价试题
高一化学
说明:
1.本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷共20小题60分;第Ⅱ卷共8小题40分,总分100分,考试时间为90分钟。
2.答第Ⅰ卷前,考生务必将自己的姓名、考号、考试科目用铅笔写,涂在答题卡上;答第Ⅱ卷前必须将自己的学校、试室号、姓名、考号填写在密封线左边的空格内。
3.可能用到的原子量:H=1,O=16,Cl=35.5,C=12,N=14 ,S=32,He=4, Ne=20, Na=23, Al=27, Mg=24
第Ⅰ卷(选择题,共60分)
一、选择题(每小题只有一个选项符合要求,每小题3分共30分)
1.我国古代文明有许多发明创造对人类的进步都产生了深远的影响。下列发明创造过程中没有发生化学变化的是
A.指南针的使用 B.酿酒制醋
C.冶金造纸 D.烧制陶瓷
2.下列说法正确的是
![]() A.光纤是用纯硅制成的
A.光纤是用纯硅制成的
B.游泳池中加漂白精主要起漂白作用
C.某些生物能将空气中的氮气转变成含氮化合物
D.大气中二氧化碳含量增大会导致酸雨发生
3.下列物质中,可用于治疗胃酸过多的是
A.氢氧化铝 B.苛性钠
C.氧化钙 D.硫酸钡
4.下列溶液中的c(Cl-)与150mL 1mol·L-的AlCl3溶液c(Cl-)相等的是
A.75mL 2mol·L-1NH4Cl溶液
B.150mL 3mol·L-1的KCl溶液
C.75mL 2mol·L-1的FeCl3溶液
D.150mL 1mol·L-1的NaCl溶液
5.下列不能产生丁达尔现象的分散系是
A.烟雾 B.食盐水
C.蒸馏水 D.鸡蛋清溶液
6.一种元素从化合态变成游离态将是
A.被氧化 B.被还原
C.产生沉淀 D.可能被氧化,可能被还原
7.在pH>7的溶液中能大量共存,且溶液为无色透明的离子组是
A.K+、MnO4-、Cl-、SO42- B.Na+、NO3-、CO32-、Cl-
C.Na+、H+、NO3-、SO32- D.Fe3+、NO3-、S2-、Cl-
8.下列离子方程式书写正确的是
A.碳酸氢钠与盐酸反应:HCO3-+H+ == CO2↑+H2O
B.锌与盐酸反应:Zn+2H++2Cl-=== Zn2++2Cl-+H2↑
C.石灰石与硝酸反应:CO32-+2H+ === CO2↑+ H2O
D.钾与水反应:K+2H2O === K++2OH-+H2↑
9.相同条件下液体水和硫酸各1mol,其体积如下图示。体积不同的主要原因是

![]()
![]()
![]()
![]()
![]() A.微粒数不同
A.微粒数不同
B.微粒间的间隔不同
C.单个微粒的体积不同
D.温度、压强不同
10.用NaCl固体配制1mol/L NaCl溶液250mL,在下列仪器中要用到的是
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯
⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A.①③⑤⑥⑦ B.②③④⑤
C.①③⑤⑥⑨ D.②③⑤⑥⑧⑨
二、选择题(每小题有1-2个选项符合要求,漏选给1分,多选、错选均不给分,每小题3分共30分)
11.等物质的量的氢气和氦气在同温同压下具有相同的
A.原子数 B.体积
C.质子数 D.质量
12.下表中物质的分类组合完全正确的是
| 编 号 | A | B | C | D |
| 强电解质 | KNO3 | NaOH | BaCl2 | HCl |
| 弱电解质 | CH3COOH | CaCO3 | HClO | NH3·H2O |
| 非电解质 | Cu | 石墨 | CaCO3 | C2H5OH |
13.实验室制取下列气体时,只能用排气法收集的是
A.NH3 B.H2
C.SO2 D.NO
14.金属钠的用途:①还原某些金属 ②做高压钠灯 ③制造过氧化钠 ④与钾混合作原子反应堆的导热剂;其中利用钠的物理性质的是
A.①② B.①③
C.②④ D.④
15.等体积的CaCl2、AlCl3两种溶液分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则CaCl2、AlCl3两种溶液的物质的量浓度之比是
A.1:1 B.2:3
C.2:1 D.3:2
16.鉴别CO2和SO2两种气体时,可选用
A.品红溶液
B.湿润的蓝色石蕊试纸
C.溴水
D.澄清的石灰水溶液
17.下列物质中,能够导电的电解质是
A.铝 B.熔融的氯化镁
C.食盐溶液 D.蔗糖
18.某集气瓶内的气体呈红棕色,加入足量的水,盖上玻璃片振荡,得无色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色。该气体可能是下列混合气体中的
A.N2、O2 B.NO2、NO、N2
C.NO2、O2、NO D.N2、NO2
19.下列化合物中,能通过单质间化合直接制取的是
A.AlCl3 B.CuS
C.NO2 D.SO3
20.t℃时,将一定量A(不含结晶水)的不饱和溶液均分为三份,分别加热蒸发,然后冷却为t℃,已知三份溶液分别蒸发水10g,20g,30g,析出A晶体的质量依次为ag,bg,cg。则a,b,c三者的关系是
A.c=a+b B.c=2b-a
C.c=2b+a D.c=2a-b
高一化学第一学期期末高中学业评价试题
高一化学
第Ⅱ卷(40分)
|
| 第Ⅰ卷(60分) | 第Ⅱ卷(40分) | 总分 | ||
| 题号 | 一 | 二 | 三 | 四 | |
| 得分 |
|
|
|
|
|
三、填空题(每空2分,共24分)
21.呼吸面具中Na2O2可吸收CO2放出O2,写出反应的化学方程式
。
22.在 K2Cr2O7
+ 14HCl![]() =
2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
=
2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂。
(2)在该反应中若有0.5mol K2Cr2O7被还原,则被氧化的HCl的物质的量为 mol。
23.将2.0gNaOH溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为 g。
24.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。检验溶液中Fe3+存在的试剂是 ,证明存在Fe3+的现象是 。写出FeCl3溶液与金属铜反应的化学方程式 。
25.等质量镁铝合金两份(铝既能与酸反应又能与强碱反应),一份与足量的盐酸作用,生成的气体在标准状况下是22.4L,而另一份与足量的烧碱溶液作用,生成相同条件下气体16.8L,则两份合金中铝的质量共有
g。
26.现有下列物质:①纯碱 ②氯化银 ③二氧化硅 ④铁 ⑤氧气 ⑥氢氧化钙 ⑦硫酸请将上述物质按下列要求分类,并将其序号填入空白处:
属于酸的是___________________,属于碱的是___________________,
既不属于电解质又不属于非电解质的是__________________________。
四、实验(共16分)
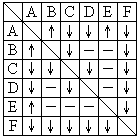 27.(6分)有A、B、C、D、E、F六瓶未知溶液,它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH。为了鉴别,各取少许溶液进行两两混和试验,结果如右表。表中“↓”表示有沉淀或生成微溶化合物,“↑”表示有气体生成,“—”表示观察不到明显的现象变化。
27.(6分)有A、B、C、D、E、F六瓶未知溶液,它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH。为了鉴别,各取少许溶液进行两两混和试验,结果如右表。表中“↓”表示有沉淀或生成微溶化合物,“↑”表示有气体生成,“—”表示观察不到明显的现象变化。
由此可以判断:
A是 B是
C是 D是
E是 F是 。
28.(10分)为获取纯净的氯化铁,进行实验。在下面的装置中,A是Cl2发生装置(实验室常用MnO2与浓盐酸反应制取),C、D为气体的净化装置,C中装有饱和食盐水,D中装有浓H2SO4,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
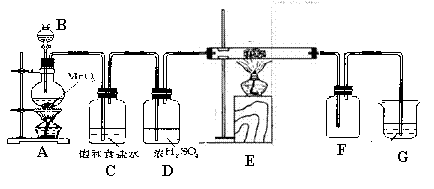 |
试回答:
(1)G中装有什么药品: 。
(2)从A中生成的气体通过C装置,C装置的作用是:
。
(3)E中生成的物质是 。
(4)写出G中发生反应的离子方程式和E中反应的化学方程式
G
E 。
高一化学第一学期期末高中学业评价试题
高一化学[参考答案]
一、二选择每小题3分共60分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | C | A | B | B | D | B | A | C | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BC | D | AC | C | D | AC | B | BD | A | B |
三、填空(每空2分,共24分)
21、2Na2O2+2CO2=2Na2CO3+O2(2分)
22、氯 K2Cr2O7 3 (6分)
23、90.0(2分)
24、KSCN或NH4SCN 溶液变红
2FeCl3+Cu=2FeCl2+CuCl2(6分)
25、27 (2分)
26、⑦ ⑥ ④⑤ (6分)
四、实验(共16分)
27、A.(NH4)2CO3 B.NaOH C.MgSO4
D.BaCl2 E.HBr F.AgNO3
(每空1分共6分)
28、(1)氢氧化钠溶液(2分)
(2)除去氯气中的氯化氢(2分)
(3)FeCl3(2分)
![]() (4)Cl2+2OH-=Cl-+ClO-+H2O
(2分)
(4)Cl2+2OH-=Cl-+ClO-+H2O
(2分)
2Fe+3Cl2=2 FeCl3(2分)