高一化学专题一学生练习
可能用到的原子量:H—1、O—16、C—12、Fe—56、Ca—40、K—39、Cl—35.5、S—32、N—14、Na—23、Zn—65、Cu—64。
一:选择题(每小题只有一个正确答案,每小题3分,共57分)
1.下列各种元素中,原子的次外层电子数等于其它各层电子数之和的元素是( )
A.Mg B.S C.O D.Ar
2.下列数字为几种元素的核电荷数,其中原子核外最外层电子数最多的是 ( )
A.8 B.14 C.16 D.17【AD】
3.碳的三种同位素12C、13C、14C的原子,下列各项对三种原子均不同的是 ( )【B】
A.核电荷数 B.中子数 C.电子层数 D.元素种类
4.核电荷数为16的元素和核电荷数为4的元素的微粒相比较,前者的下列数据一定是后者的4倍的是( )【AD】
A.电子数 B.最外层电子数 C.电子层数 D.次外层电子数
5.在核电荷数为1~20的元素中,最外层电子数和电子层数相等的元素共有( )
【A】A.3种 B.4种 C.5种 D.6种
6.质子数和中子数相同的原子A,其阳离子An+核外共有x个电子,则A的质
量数为 ( )
A. 2(x+n) B. 2(x-n) C. 2x D. n+2x
7.某元素R原子的核外电子数等于核内中子数,该元素的单质2.8g,与氧气充分反应,可得到6g化合物RO2,则该元素的原子 ( )
A. 具有三层电子最外层电子数为4 B. 具有二层电子最外层电子数为4
C. 具有三层电子最外层电子数为5 D. 具有二层电子最外层电子数为5
8.下列叙述中能肯定说明金属A比金属B的活泼性强的是 ( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子电子层数多
C.1mol A从酸中置换出的H2比1molB从酸中置换的H2多
D.常温时,A能从酸中置换出氢,而B不能
9.下列叙述中, 错误的是 ( ) 【A】
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO4
10.对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH>Mg(OH)2>Al(OH)3
B.原子半径:Na<Mg<Al
C.离子半径:Na+<Mg2+<Al3+
D.单质的还原性:Al>Mg>Na
11.元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。请你在元素大厦中为119号元素安排好它的房间 ( )
A.第八周期第IA族 B.第七周期第 ⅦA族
C.第七周期第0族 D.第六周期第ⅡA族
12.元素A的最高正价和负价的绝对值之差为6,B元素和A元素原子的次外层都有8个电子,BA2在水溶液中电离出电子层结构相同的离子,则BA2是 ( )
A.MgF2 B.CaCl2 C.K2S D.Na2O
13.X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是 ( )
A.如X、Y均为金属元素,则X的金属性强于Y
B.如X、Y均为金属元素,则X的阳离子氧化性比Y形成的阳离子强
C.如X、Y均为非金属元素,则Y的非金属性比X强
D.如X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X
14.短周期的三种元素a、b、c在周期表中的位置关系如图,
| a |
| ||
| b | |||
|
| c |
下列有关a、b、c三种元素的叙述中, 正确的是 ( )
A.a是一种活泼金属元素
B.c 的最高价氧化物的水化物是强酸
C.b的氢氧化物是强碱
D.c的最高价氧化物的水化物是两性氢氧化物
15.下列每组物质发生状态变化时所克服的粒子间的相互作用力属于同种类型的是: ( )
A.食盐和蔗糖的熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化镁熔化
16.元素A原子L电子层比元素B原子L电子层少2个电子,电子总数比B少3个电子,则A与B可形成 ( )
A.离子化合物B2A B.离子化合物BA2
C.共价化合物BA3 D.共价化合物AB4
17.下列物质的性质与氢键无关的是 ( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.NH3分子比PH3分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
18.有关晶体的下列说法中正确的是 ( )
A 晶体中分子间作用力越大,分子越稳定 B 原子晶体中共价键越强,熔点越高
C 冰熔化时水分子中共价键发生断裂 D 氯化钠熔化时离子键未被破坏
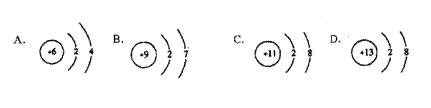 19.在下图所表示的微粒中,氧化性最强的是
(
)
19.在下图所表示的微粒中,氧化性最强的是
(
)
二、填空题(43分)
20.(4分)在下列物质中(填序号)(A)Cl2 (B)NaI (C)H2S(D)CO2 (E)CaCl2 (F)N2(G)CCl4 (H)Na2O(I)NH3(J)HBr
(1)含离子键的物质是__________________;(2)含有共价键化合物的是
_________________________________。
21.(10分)A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。它们的元素符号分别为:A ___ ;B ____ ;
C __ ;B原子的结构示意图为 ;BC2的电子式
___________________.
22.(5分)有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此推知(填元素符号):V是________,W是________,X是________,Y是________,Z是________。
23.(3分)A、B、C是周期表中相邻的三种元素, 其中A、B同周期, B、C同主族. 此三种元素原子最外层电子数之和为17, 质子数总和为31, 则A、B、C分别是________、________、_______。
24.(10分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号 __ ;D的原子结构示意图 _______ 。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 ____ 。
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是 (填写具体的化学式 )。
(4)CA2与D元素的单质在水溶液中反应的化学方程式是 ______ 。
25.(4分)有下列各组粒子或物质,请用字母回答:
A、白磷与红磷; B、16O、17O与18O; C、水与冰;
D、正戊烷、异戊烷与新戊烷; E、乙醇与二甲醚。
_____________组粒子互为同位素;_______________组物质互为同素异形体;_____________组物质互为同分异构体;______________组物质互为同种物质。
26.(7分)a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代号 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数:(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是四原子分子;c与f可形成两个共价型g分子。试写出:
(1)、a粒子的电子式__________________;
(2)、b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________>_______________(用化学式表示)
(3)、d溶于水的电离方程式____________________________________;
(4)、g粒子所构成的晶体中存在的作用力为______________________;
(5)、c粒子是_____________,f粒子是________________(用化学式表示)。