高一级第二学期半期化学试题
可能用到的相对原子质量:H-1,O-16,S-32,Cu-64,Zn-65
第I卷 选择题(共48分)
一、选择题(共16小题,每题3分,共48分。只有一个选项符合题意。)
1.提出元素周期律并绘制了第一个元素周期表的科学家是
A.戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿
2.下列物质的晶体中,既含有离子键,又含有非极性共价键的是
A.NaOH B.Na2O2 C.CaCl2 D.H2O2
3.下列电子式中,正确的是
A
. ![]() B.
B. ![]()
|
C.![]() D.
D.
4.下列说法中,正确的是
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
5.实验室用一种准确的仪器来分别测定一个氢分子的质量时,所得的数值可能是:
A.3种 B.4种 C. 5种 D.6种
6.国际无机化学命名委员会在1989年作出决定,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,碱金属族为第1列,稀有气体为第18列。按这个规定,下列说法不正确的
A.第15列元素的最高价氧化物为R2O5
B.第2列元素中肯定没有非金属元素
C.第17列元素的第一种元素无含氧酸
D.第16、17列元素都是非金属元素
7.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. A、B、C、D、E B. E、C、D、B、A
C. B、A、D、C、E D. C、D、A、B、E
8.下列分子中所有原子都满足最外层为8个电子结构的是
A.BF3 B.CCl4 C.H2O D.PCl5
9.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A.x+2 B.x+4 C.x+8 D.x+18
10.下列各组物质的性质及粒子变化正确的是
A. 酸性:HClO4>H2SO4>H3PO4>H2CO3
B. 稳定性:H2S>HCl>HBr>HI
C. 粒子半径:Br—>K + >S2— >S
D. 还原性:Na>S2— >Cl—>Br— >I-
11.某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子物质的量为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
12.下列关于过氧化氢的说法正确的是
A. 过氧化氢具有杀菌消毒作用,是强酸
B. 过氧化氢是离子化合物
C. 过氧化氢可以发生分解反应
D.过氧化氢是水的同素异形体
13.下列反应的离子方程式正确的是:
A. 将SO2通入Ca(ClO)2溶液中:
SO2 + H2O + Ca2+ + 2ClO- = CaSO3↓+ 2HClO
B. 氯气溶于水:Cl2 + H2O = 2H+ + Cl- + ClO—
C. 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全:
Ba2+
+ 2OH-+ 2H+
+ SO![]() = BaSO4↓+2H2O
= BaSO4↓+2H2O
D.用NaOH溶液吸收尾气Cl2: Cl2 + 2OH—= Cl—+ClO—+H2O
14.下列变化的实质相似的是:
A.浓H2SO4和浓HCl在空气中敞口放置时浓度均减小.
B.SO2和Cl2均能使品红溶液褪色.
C.浓H2SO4和稀硫酸与锌反应均生产气体.
D.HBr,HI气体不能用浓H2SO4制取
15.用30ml 0.1mol/L Na2SO3溶液恰好将0.002molXO4-还原,则X元素在还原产物中的化合价为( )
A.+1 B.+2 C.+3 D.+4
16. 向一定量的浓H2SO4溶液中加入Wg的铜片并加热,充分反应后,得到V LSO2气体,则被还原的H2SO4不可能是
A. 98V/22.4g B. 98V/34g C. W/64mol D. W/32mol
 第I卷答案
第I卷答案
|
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
第II卷非选择题(共52分)
17.(9分)在原子序数为1─18号元素中:(填元素符号或化学式)
(1)与水反应最剧烈的金属元素是________
离子方程式为__________________________________
与水反应最剧烈的非金属元素是________
化学方程式为___________________________________
(2)第三周期中原子半径最大的金属元素是_______________,元素的最高价氧化物所对应的水化物酸性最强的化合物是___________。(3)能吸收紫外线对地球起保护的物质是_________
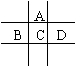 18.(8分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
18.(8分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
(1)画出A离子的结构示意图:______________
(2)B在元素周期表中的位置是_________________
(3)C单质在A单质中燃烧的反应现象是_______________________
B单质在D单质中燃烧生成物的化学式为__________________
(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________,与强碱溶液反应的离子方程式为_________________________________
19.
|
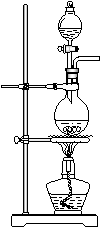 (13分)据下图回答
(13分)据下图回答
![]() :
:
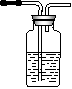
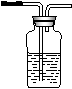
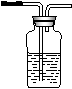
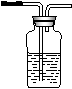
![]()
![]() A
A
B C D E
(1)写出木炭与浓硫酸反应的化学方程式_____________________
(2)如果用图中的装置检验上述反应的全部产物,写出下面装置应加入的试剂名称及作用:
①A中加入的试剂是_________,作用是_______________________
②B中加入的试剂是_________,作用是_______________________③E中加入的试剂是__________,作用是_____________________
(3)实验时,C中若加入的是溴水,则C中发生反应的离子方程式为_____________________________________
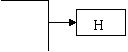
20.(12分)已知B、D是淡黄色固体且D为单质,A与D反应生成离子化合物.有下面转化关系:
 | |||
![]()
![]()
![]()
![]()
![]()
 | ||||||||
![]()
![]()
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1)写出C的电子式: _________,X的结构式____________。
(2)写出下列反应的离子方程式:
①B+H2O_______________________________________________________
②F+H2O_________________________________________________
(3)上述转化关系中有一个是可逆反应,则该反应的化学方程式为
________________________________________________________
(4)写一个化学方程式能证明D元素的非金属性小于Cl元素的非金属性_________________________________________________
(5)检验H溶液中阴离子的实验操作和实验现是____________
_______________________________________________________
________________________________________________________21.(10分)一定量的Zn与100ml18.5mol/L的浓硫酸充分反应,ZN完全溶解,同时在标准状况下生成33.6L气体A,将反应后的溶液稀释至1L,测得溶液中C(H+)=0.1mol/L,则:
(1)气体A的组成成份为____________________(填化学式)
(2)写出有关的化学方程式________________________________
________________________________________________________
(3)气体A中各组成成份体积比为____________________________
(命题:江安中学化学组 魏旭)
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | B | D | B | C | D | C | B |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| B | A | C | C | D | D | D | C |
评分时注意:所有的化学用语完全正确才得分!
17.(9分)(1)Na,2Na+2H2O=2Na++2OH-+H2↑
F,F2+2H2O=4HF+O2(2)Na,HClO4,O3
18.(8分)(1)略(2)第三周期第VA族
(3)发出明亮的蓝紫色火焰.PCl3,PCl5
(4)Al2O3,两性氧化物, Al2O3 +20H-=2AlO2-+H2O
19.(13分)(1)C+H2OS4=CO2↑+SO2↑+H2O(注明条件才得分)
(2)无水硫酸铜,验证H2O的存在;
品红溶液,验证SO2的的存在;
澄清石灰水,验证CO2的存在;
(3)Br2+SO2+2H2O=4H++2Br-+SO42-
20.(12分)(1)略(2)2Na2O2+2H2O=4Na++4OH-+O2↑,SO3+H2O=2H++SO42-
![]()
![]() (3)2SO2+O2 2SO3(注明条件才得分)
(3)2SO2+O2 2SO3(注明条件才得分)
(4)H2S+Cl2=S↓+2HCl(其他合理也可)(5)略
21.(10分)(1)SO2 H2
(2)Zn+2H2SO4=ZnSO4+SO2↑+2H2O(注明条件才得分)Zn+H2SO4=ZnSO4+H2↑
(3)1:4
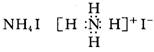
 1
1