高一级化学科第二学期期中考试试卷
第 I 卷
可能用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23, Cl-35.5
第Ⅰ卷(选择题,共44分)
一、选择题(每小题只有1个选项符合题意,每小题2分,共10小题,共20分)
1.元素的种类和原子的种类
A.大于 B.小于 C.等于 D.不能确定
2.金属阳离子R3+核外有28个电子,其质量数为70,则核内的中子数是
A.42 B.39 C.31 D.28
3.下列粒子中,互为同位素的是
A.40K和40Ca B.H2和D2
C.24Mg和26Mg D.O2和O3
4.某元素最高价氧化物对应水化物的化学式为H2XO3,这种元素的气态氢化物的化学式为
A.HX B.XH4 C.H2X D.XH3
5.下列递变情况中,正确的是
A.Na、Mg、Al的还原性依次增强 B.P、S、Cl元素的最高正价依次降低
C.C、N、O的原子半径依次减小 D.Li、Na、K的金属性依次减弱
6.镭是周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是
A.在化合物中呈+2价 B.单质与水反应放出氢气
C.氢氧化物呈两性 D.碳酸盐难溶于水
7.对照元素周期表, 下列叙述中不正确的是
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在金属元素区域可以寻找制备新型农药材料的元素
D.为新元素的发现和预测它们的原子结构和性质提供线索
8.下列物质中既含有离子键,又含有非极性共价键的是
A.NaOH B.Na2O2 C.MgCl2 D.H2O
9.下列说法正确的是
A.反应物的总能量大于生成物的总能量的反应是放热反应
B.放热反应全部不需要加热即可发生
C.需要加热条件的化学反应都是吸热反应
D.由H原子形成1 mol H—H键要吸收热量
10.关于如图所示装置的叙述,正确的是
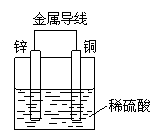 A.铜是负极,铜片上有气泡产生
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
二、选择题(本题包括10小题,每小题3分,共30分。每小题可能有1或2个选项符合题意,若符合题意的选项有两个时,选对1个得1分,两个都选对得3分,但凡是选有不符合题意的选项时,该小题就为零分)。
11.X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是
A.R一定是共价化合物
B.R一定是离子化合物
C.R可能是共价化合物,也可能是离子化合物
D.R可能是气态物质,也可能是固态物质
12.某一反应物的浓度是2mol/L,经过4min后,它的浓度变成1.68 mol/ L,则在这4min内它的平均反应速率为
A.0.2 mol/(L·min) B.0.1 mol/(L·min)
C.0.04 mol/(L·min) D.0.08 mol/(L·min)
13.用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,为了降低化学反应的反应速率,欲向溶液中加入下列物质,你认为可行的是
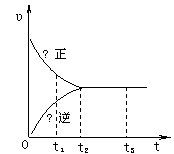 A.蒸馏水 B.加热 C.NaCl溶液 D.浓盐酸
A.蒸馏水 B.加热 C.NaCl溶液 D.浓盐酸
14.右图是可逆反应X2 + 3Y2
![]() 2Z2 在反应
2Z2 在反应
过程中的反应速率(υ)与时间(t)的关系曲线,
下列叙述正确的是
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
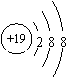
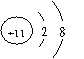 D.t2- t3,各物质的浓度不再发生变化
D.t2- t3,各物质的浓度不再发生变化
15.根据下列微粒结构示意图的共同特征,可以把
三种微粒归为一类。下列微粒中可以归为一类的是( )
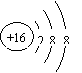 | |||||||
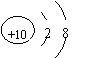 | |||||||
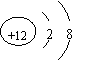 | 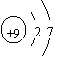 | ||||||
A. B. C. D.
16.下列说法正确的是( )
A.原电池是把电能转化为化学能的装置
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化还原反应
D.原电池中的阳离子向正极移动
17.反应4NH3(g)+5O2=4NO+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒浓度变化正确的是( )
A.NO: 0.001 mol/L B.H2O:0.002 mol/L
C.NH3:0.002 mol/L D.O2:0.0012 mol/L
18.如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。气体X和液体Y不可能是( )
| X | Y | |
| A | HCl | 饱和食盐水 |
| B | CO2 | 稀H2SO4 |
| C | SO2 | NaOH溶液 |
| D | NH3 | 水 |
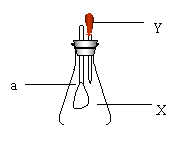
19.氢氯混和气体在光照的条件下可以发生爆炸。在反应过程中,假设破坏1mol氢气中的化学键需要消耗的能量为Q1kJ,破坏1mol氯气中的化学键需要消耗的能量为Q2kJ,形成1mol氯化氢可以释放出的能量为Q3kJ。下列关系正确的是 ( )
A. Q1+Q2> Q3 B.Q1+Q2> 2Q3 C.Q1+Q2< Q3 D.Q1+Q2<2Q3
![]() 20.一定温度下,某密闭且体积不变的容器内有可逆反应:A(g)+3B(g) 2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是
( )
20.一定温度下,某密闭且体积不变的容器内有可逆反应:A(g)+3B(g) 2C(g)。该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是
( )
A.C物质的生成速率和分解速率相等
B.容器内气体的密度不再随时间而改变
C.单位时间内生成amol物质A,同时生成3amol物质B
D.A、B、C物质的分子数之比为1:3:2
三、填空题(包括5小题,共34分)
19.(4分)有以下几种物质,按要求填写物质代号:
A.金刚石 B.D2O C.126C D.C60 E.H2O2
F.H2O G.CO2 H.146C I.KOH J.147N
(1) 属于同素异形体的是____________
(2)互为同位素的是______________
(3)含有极性键的离子化合物的是_____________
(4)既含有非极性键又含有极性键的是____________
20.(5分)下面是元素周期表的一部分,针对①—⑩元素填写下列空白
| 主族 周期 | IA | O | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ | ||||||
(1)在这些元素中,属于金属元素的有________________(填元素符号),其中
金属性最强的是 (填序号)
(2)写出①和⑥的最低价形成气态分子的化学式______________,⑦的最高价氧化物对应的水化物的化学式为 。
(3)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
21.(12分)短周期元素W、X、Y、Z原子序数依次增大,已知W元素原子核外只有1个电子,X元素在周期表中所处的族序数是周期序数的3倍,Y元素原子失去1个电子后,与氖原子电子排布相同。Z元素与Y元素在同一周期,Z原子结合一个电子后,最外层形成8电子稳定结构。根据以上事实回答:
(1)(2分)写出X元素在周期表中的位置_________________________ _
(2)(2分)Y原子结构示意图为______ ;Z离子的结构示意图为______ ___
(3)(2分)用电子式表示W原子与Z原子形成化合物的过程___________________
(4)(2分)Y单质可以在X单质中燃烧,反应的化学方程式为:
(5)(4分)由W、X、Y组成的化合物中含有__________键和________键,
属于_______化合物,写出该化合物的电子式
22.(5分)在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小颗粒
(2)夏天的食品变霉,在冬天不易发生该现象
(3)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同
(4)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体
(5)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢
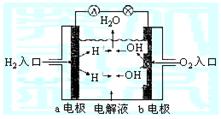
|
(1)该燃料电池的正极是 电极, (填物质名称)发生还原反应;
(2)该燃料电池的负极是 电极, (填物质化学式)发生氧化反应;
(3)燃料电池中是将 能转化为 能,总反应式是 。
四、实验题(7分)
24.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:
Zn + CuSO4 = ZnSO4 + Cu
(1)画出装置图并标明电极材料和电解质溶液:(3分)
(2)写出两个电极的电极反应式:(4分)
五、计算题(9分)
25.(9分)工业上氨气的制取是在高温、高压和催化剂的条件下进行的,并且该反应属于可逆反应,即该反应达到一定限度后,就会在反应物、产物浓度上保持一种动态的平衡(即化学平衡)。
(1)请你填写下表中的空白
| N2 | H2 | NH3 | |
| 反应开始时的浓度 | 1.5mol/L | 4.5mol/L | 0 |
| 10min后的浓度 | ① | 4.2mol/L | ② |
| 反应速率 | ③ | ④ | ⑤ |
(2)比较是一种重要的化学学习方法。请用比较的方法归纳上表中反应速率与化学方程式中的计量系数的关系: 。
参考答案
一、二选择题(单选每题2分,不定选每题3分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | C | B | C | C | C | B | A | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | CD | D | AC | BD | C | D | A | B | D | A |
19(1)AD (2)CH (3)I (4)E
20 (1)Na Al k ;⑨
(2)H2S HClO4
(3)IVA族
![]() 21、(1)第二周期第ⅥA族
21、(1)第二周期第ⅥA族
(2)
![]() (3)
(3)
(4)2Na + O2 ![]() Na2O2
Na2O2
![]() (5)离子键;极性共价键;离子;
(5)离子键;极性共价键;离子;
22.(1)反应物的接触面积;(2)反应温度;(3)反应物的浓度;(4)催化剂
(5)反应物的本性
23. (1)b;氧气;
(2)a; H2;
(3)化学;电;2H2+O2=2H2O(2分)
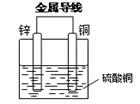 24.(1)(3分)
24.(1)(3分)
(2)(4分)负极:Zn — 2e— = Zn2+;正极:Cu2+ + 2e— = Cu
25、(1)①1.4mol/L(2分);②0.2mol/L;(2分)③0.01mol/(L·min);(1分)④0.03mol/(L·min);(1分)⑤0.02mol/(L·min);(1分)(2)各物质(包括反应物和产物)的反应速率与化学计量系数成正比。(2分)