高一化学(必修)期中考试试卷
命题人:朱莉
(考试时间:75分钟 满分:100分)
可能用到的相对原子质量 C:12 H:1 O:16
一、选择题(本题包括20小题,第1—15题每小题2分,第16—20题每小题3分,共45分,每小题只有一个选项符合题意,请将它的编号填入答案卷对应的空格中。)
1.下列关于化学键叙述正确的是
A.离子化合物中不可能含共价键 B.共价化合物中可能含离子键
C.离子化合物中只含离子键 D.共价化合物中不含离子键
2.某元素的两种同位素,它们的原子具有不同的
A.质子数 B.质量数 C.原子序数 D.电子数
3.下列有关燃料燃烧的说法正确的是
A.使燃料充分燃烧空气的量越多越好
B.物质燃烧都需要氧气
C.水煤气不属于化石燃料,而煤、石油、天然气属于化石燃料
D.煤气是目前世界上最理想的气体燃料
4.下列关于化学反应速率的说法中,错误的是
A.化学反应速率用于衡量化学反应的快慢
B.决定化学反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.增大反应物浓度,提高反应物温度都能增大反应速率
5.1999年是人造元素丰收年,一年间得到了核电荷数分别为114、116、118三种新元素。已知核电荷数为118的新元素的一种原子的质量数为293,则该原子里中子数与电子数之差为
A.0 B.57 C.118 D.175
6.某元素原子的最外层只有2个电子,则该元素
A.一定是ⅡA族元素 B.—定是金属元素
C.一定是正二价元素 D.可能是金属元素,也可能不是金属元素
7.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是
A.原子半径:X>Y>Z B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z D.原子序数: Z>Y>X
8.下列有关电子运动的说法中,错误的是
A.电子不停地作高速运动 B.离原子核近的电子能量低,离原子核远的电子能量高
C.不同的电子形成不同的电子层 D.电子在核外是分层排布的
9.下列物质中既有离子键又有共价键的是
A. H2O B. Na2O C.NH4Cl D.CCl4
10.下列过程中需要增大化学反应速率的是
A、钢铁腐蚀 B、食物腐败 C、塑料老化 D、工业合成氨
11.下列叙述中,正确的是
A.需加热的反应不一定是吸热反应 B.化合反应一定是放热反应
C.放热反应不需要加热或点燃等条件 D.分解反应一定是放热反应
12.下列物质中不存在化学键的是
A.氖气 B.氢气 C.氧气 D.氨气
13.可逆反应2A(g)+3B(g) ![]() 2C(g)+D(g)在四种不同条件下的反应速率分别为:①υ(A)=0.5mol·L-1·s-1;②υ(B)=0.6mol·L-1·s-1;③υ(C)=0.35mol·L-1·s-1;④υ(D)=0.4mol·L-1·s-1,则该反应在不同条件下反应速率最快的是
2C(g)+D(g)在四种不同条件下的反应速率分别为:①υ(A)=0.5mol·L-1·s-1;②υ(B)=0.6mol·L-1·s-1;③υ(C)=0.35mol·L-1·s-1;④υ(D)=0.4mol·L-1·s-1,则该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
14.下列叙述错误的是
A.使阴、阳离子结合成化合物的静电作用叫做离子键
B.金属元素与非金属元素相化合时一定形成离子键
C.化合物中只要含有离子键就一定属于离子化合物
D.含共价键的化合物不一定是共价化合物
15.下列气态氢化物中,最稳定的是
A.PH3 B.H2S C.SiH4 D.HCl
16.在mA+nB![]() pC的反应中m、n、p为各物质的化学计量数,现测得C每分钟增加a mol·L-1,B每
pC的反应中m、n、p为各物质的化学计量数,现测得C每分钟增加a mol·L-1,B每
分钟减小1.5a mol·L-1,A每分钟减少0.5a mol·L-1,则m:n:p为
A.2:3:2 B.2:2:3 C.1:3:2 D.3:1:2
17.有两种短周期元素X、Y,它们的原子序数分别为8和11,下列有关X、Y两种元素的描述中正确的是
A.X元素只能形成-2价的化合物
B.Y位于元素周期表的第3周期第IIA族
C.X原子的半径大于Y原子的半径
D.X、Y之间能形成Y2X和Y2X2两种离子化合物
18.下列说法中正确的是
A.SO2、SO3互为同分异构体 B.元素组成相同,分子结构不同的物质是同分异构体
C.碘晶体、碘蒸气是同素异形体 D.同素异形体是同种元素组成的不同单质
19.下列说法中正确的是
A.所有的原子核内质子数都比中子数多
B.氢离子(H+)实质上是一个裸露的质子
C.核外电子排布相同的微粒,其化学性质也相同
D.非金属元素原子最外层电子数都大于4
20.在一定温度下,反应A2(气)+B2(气)![]() 2AB(气)达到平衡的标志是
2AB(气)达到平衡的标志是
A.单位时间生成n mol的A2同时生成n mol的AB
B.容器内的总压不随时间变化
C.单位时间生成2n mol的AB同时生成n mol的B2
D.单位时间生成n mol的A2 同时生成n mol的B2
 高一年级试卷
高一年级试卷
化 学 试 题 答 题 卷
一、选择题(本题包括20小题,第1—15题每小题2分,第16—20题每小题3分,共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
二、填空和简答题(共40分)
21.(4分)我们通常用 来衡量化学反应的快慢。它可用 的减少或 的增加来表示,其常用单位是 。
22.(4分)根据下列图示,写出反应的热化学方程式:
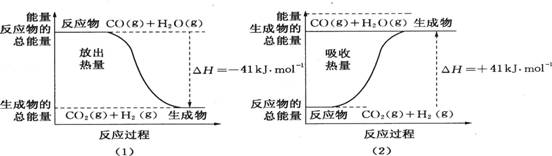
(1) 、
(2) 。
23.(8分)A、B、C、X四种元素在周期表短周期中位置如下表,已知X元素最高价氧化物的化学式为X2O5,试确定:
| B | ||
| …A | X | C… |
(1)各元素的符号:
A B C X
(2)写出A、C、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序 。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序 。
24.(9分)有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
(1)依次写出甲、乙、丙三种元素的元素符号
(2)写出甲、乙、丙三种元素组成的化合物在水中的电离方程式
(3)画出甲元素的原子结构示意图和丙离子的结构示意图 、 。
25.(4分) 由1H216O与2H217O所代表的物质中,共有___________种元素,___________
种原子, ___________种分子,互为同位素的原子有 ___________ 。
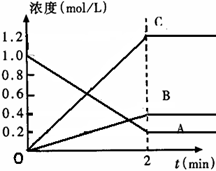 26.(6分)右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t表示时间。试回答:
26.(6分)右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t表示时间。试回答:
(1)该反应的反应物是 。
(2)该反应的化学方程式为 。
(3)达到平衡状态的所需时间是2min,A物质的平均反应速率为 。
27.(5分)室温下,将2g苯(C6H6)完全燃烧生成
液态水和CO2,放出83.6kJ的热量,写出C6H6燃烧时的热化学方程式
。若lg水蒸汽转化成溶液水放热2.44kJ,则室温下C6H6完全燃烧生成1mol水蒸气时的燃烧热为 。
 三、实验探究题(共计10分)
三、实验探究题(共计10分)
28.(10分)在常温下,按右图装配好装置,待内外空气压强相等时,
水银柱液柱在A处。取下橡皮塞,在玻璃燃烧匙中加入适量二硫化碳
液体,用酒精灯点燃并迅速移入锥形瓶中,塞紧橡皮塞。发现二硫化
碳安静地燃烧,生成CO2和SO2,水银柱推向左管。回答下列问题:
(1)写出二硫化碳燃烧的化学方程式:
(2)说明水银柱被推向左管的原因:
(3)火焰熄灭后,静置到恢复原温度和压强,水银柱的位置应该 ( )
A.仍在A处 B.高于A处 C.低于A处
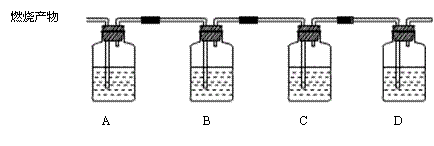 (4)用KMnO4溶液、品红试液、澄清石灰水以及下图所示装置验证二硫化碳燃烧的产物:
(4)用KMnO4溶液、品红试液、澄清石灰水以及下图所示装置验证二硫化碳燃烧的产物:
![]()
A、B、C、D中所盛放的药品分别是:A B
C D
四、计算题(共计5分)
29.(5分)第Ⅳ主族元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。
(1)试求n和m的值;
(2)试求R的相对原子质量a:
友情提醒:试题结束,请认真检查。
高一化学(必修)期中考试试卷
试题答案
一、选择题(1—15每题2分,16—20每题3分,共45分)
1。D 2。B 3。C 4。C 5。B 6。D 7。B 8。C 9。C 10。D 11。A 12。A 13。D
14。B 15。D 16。C 17。D 18。D 19。B 20。C
二、填空和简答题
21.化学反应速率、反应物浓度 生成物浓度
22.略
23.Si、N、S、P;H2SO4、H3PO4、H2SiO3;NH3、PH3、SiH4。
24.(1)Na H O (各1分) (2)NaOH====Na+ + OH- (2分)(3)略(各2分)
25.2 、4 、2、略
26.(6分,每格2 分)
(1)A
(2)__2A ![]() B +3C ___。(不配平、无可逆符号不得分)
B +3C ___。(不配平、无可逆符号不得分)
(3)_0.4 mol/(L·min) __。
27.(3分) C6H6(1)+15/2O2(g) 3H2O(1)+6CO2(g); △H=-3260.4kJ/mol
(2分) 3128.64kJ/mol (2分)
三、实验探究题
28.(1)CS2 + 3O2 ![]() CO2 + 2SO2 (2)反应放热导致椎形瓶内气体膨胀
CO2 + 2SO2 (2)反应放热导致椎形瓶内气体膨胀
(3)A (4)品红试液、KMnO4溶液、品红试液、澄清石灰水
四、计算题
29.(1)、
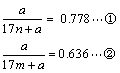
由①②式解得![]() ,n=2,m=4.
,n=2,m=4.
由于R为碳族元素,所以其主要化合价有+2,+4价,即其氢氧化物只有两种形式:R(OH)2和R(OH)4,所以n=2,m=4
(2)将n=2 代入①式,或将m=4代入②式,解得a=119