高一《化学1》自测试卷
注意:请大家对每个问题、每个选项都做到认真思考、真正理解,熟悉典型题型的解题方法
可能用到的相对原子质量:H:1 O:16 Mg:24 S:32
第Ⅰ卷(共45分)
一、选择题(本题包括26小题;每小题2分,每小题只有一个选项符合题意。共52分)
1.下列燃料中,不属于化石燃料的是
A.汽油 B.煤 C.天然气 D.氢气
2.酸雨的形成主要是由于
A.森林遭到乱砍滥伐,破坏了生态平衡 B.工业上大量燃烧含硫燃料
C.金属矿石的冶炼 D.大气中二氧化碳含量增多
3.下列物质露置在空气中质量会减少的是
A.Na2O固体 B.浓H2SO4 C.NaCl晶体 D.浓HCl
4.下列各物质中属于纯净物的是
①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3·10H2O ⑥氨水 ⑦液氨
A.①④ B.①⑤⑦ C.①⑤⑥ D.⑤⑦
5.下列反应中,不属于氧化还原反应的是
A.NaOH与NH4Cl反应 B.铝在浓硫酸中钝化 C.铁与稀盐酸反应 D.点燃甲烷
6.下列除去括号内杂质的方法正确的是
A.碳酸氢钠固体(碳酸钠):加热 B.氯化亚铁溶液(氯化铁):加入铜粉
C.CO2(HCl):饱和NaCl溶液 D.氯化钠溶液(碳酸氢钠):加足量盐酸,加热
7. 下列说法中,正确的是
A. 失去电子是还原剂,具有氧化性 B. 氧化还原反应的本质是元素化合价的升降
C. 阳离子只有氧化性,阴离子只有还原性 D.某元素由化合态变为游离态,则可能被氧化
8.下列说法正确的是
A.可以用排水法收集NH3 B.可以用向上排空气法收集NO
C.少量液溴要加水后密封保存 D.氯水可以用无色透明的试剂瓶盛装保存
9.下列表达式不正确的是
A.NaHCO3== Na++HCO3- B.H2CO3![]() 2H++CO32- C.S2-:
2H++CO32- C.S2-:![]() D.Al:
D.Al:![]()
10.下列各组离子在溶液中能大量共存的是
A.Fe3+、Na+、Cl-、SCN- B.NH4+、Na+、Cl-、OH-
C.K+、Zn2+、NO3-、Cl- D.Ba2+、H+、Cl-、AlO2-
11.对下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.常温下,浓硝酸可以用铝容器贮存,说明铝与浓硝酸不反应
C.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
D.反应CuSO4+H2S→CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
12.把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的形式是
A.Al3+ B.Al(OH)3 C.AlO2- D.Al3+和Al(OH)3
13.下列离子方程式书写正确的是
A.FeCl2溶液中通入:Cl2:2Fe2++Cl2 == 2Fe3++2Cl-
B.Mg(OH)2溶液与硫酸的反应:OH-+H+ = H2O
C.金属钠放入水中:Na+H2O = Na++OH-+H2↑
D.AlCl3溶液中加入过量氨水:Al3++4OH- == AlO2-+2H2O
14.只用一种试剂就能将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液加以区别,这种试剂是
A.KSCN溶液 B.BaCl2溶液 C.NaOH溶液 D.HCl溶液
15. 有四位同学分别对四种溶液中所含的离子进行检测,所得结果如下,其中所得结果正确的是
A. 无色溶液加入NaOH溶液加热,产生使湿润红色石蕊试纸变蓝的气体,原溶液一定含NH4+
B. 无色溶液进行焰色反应时产生的焰色是紫色,原溶液一定含Na+
C. 无色溶液加入BaCl2溶液有白色沉淀,再加入稀硝酸白色沉淀不消失,原溶液一定含SO42-
D. 无色溶液加入盐酸,加入盐酸产生无色气体,原溶液一定含CO32-
16.下列物质中属于非电解质,但是放入水中所得溶液导电性明显增强的是
A.乙醇 B.金属钠 C.三氧化硫 D.氯化钠
17.下列变化需加入氧化剂才能实现的是
A.Fe2+→Fe3+ B.CO32-→HCO3- C.Cu2+→Cu D.Cl2→HCl
18.下列说法正确的是(NA表示阿伏加德罗常数的数值)
A.在常温常压下,22.4L N2含有的分子数为NA
B.在常温常压下,1mol 氩气中含有的氩原子数为NA
C.1L 0.100mol·L-1 Na2SO4溶液中所含氧原子数为0.4NA
D.24g镁与盐酸反应时失去的电子数为NA
19.将百分比浓度为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是
A.c2=c1 B.c2<c1 C.c2>2c1 D.无法确定
20.取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为A
A.1:1 B.2:3 C.3:2 D.1:6
21. 下列叙述正确的是
A. 利用一束强光可以鉴别溶液与胶体溶液 B. 利用焰色反应可以检验所有金属离子
C. 过滤可以分离所有固体混合物 D. 氯气可使浊水澄清并消毒
22. 电子层结构相同的两种粒子的符号分别为![]() 和
和![]() ,则下列关系中正确的是
,则下列关系中正确的是
A. a+b=c+d B. a+c=b+d C. a+c=b-d D. a-c=b-d
23. 下列微粒中,跟NH4+的电子总数和质子总数都相同的是
A. Ne B. F- C. CH4 D. H3O+
24. 制印刷电路时常用氯化铁作为腐蚀液。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,此时可能发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2、2FeCl3+Fe=3FeCl2、Fe+CuCl2=FeCl2+Cu,反应结束后,下列结果不可能出现的是
A. 烧杯中的单质有铜无铁 B. 烧杯中的单质有铁无铜
C. 烧杯中的单质铜、铁都有 D. 烧杯中的单质铜、铁都无
25. 将铜片投入到稀硫酸中,铜片不溶,再加入下列试剂后,仍不能使铜片溶解的是CD
A.新制漂白粉 B.硫酸钠晶体 C.硝酸钠晶体 D.氯化铁晶体
26.根据下列反应判断物质的氧化性由强到弱的顺序正确的是
①Cl2+2KI==I2+2KCl ②2FeCl3+2HI==I2+2FeCl2+2HCl
③2FeCl2+Cl2==2FeCl3 ④I2+SO2+2H2O==2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>SO2>I2 D.Cl2>Fe3+>I2>SO2
班 号 姓名 成绩
一、选择题(本题包括26个小题,每个小题只有1个选项符合题意。共52分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 (共48分)
二、(本题包括5小题;共24分)
27(4分)
⑴电解食盐水的化学方程式:
⑵氯气通入氢氧化钠溶液中的离子方程式:
⑶氯化铁溶液中加入硫氰化钾的离子方程式:
28(8分)
⑴在化学方程式中标出下列反应的电子转移方向和数目,并回答问题。
3Cl2+6KOH![]() 5KCl+KClO3+3H2O 被氧化的氯元素占全部氯元素总质量的 %;氧化剂和还原剂质量比为 ;氯气表现
性;当转移1mol电子时有 mol KClO3生成。
5KCl+KClO3+3H2O 被氧化的氯元素占全部氯元素总质量的 %;氧化剂和还原剂质量比为 ;氯气表现
性;当转移1mol电子时有 mol KClO3生成。
⑵写出指定物质的化学式:胆矾 ;孔雀石 ;明矾 。
29(4分)从Cl2分别与KBr、KI,Br2与KI的反应中,你发现的规律是(能归纳几条写几条):
。
30(2分)某无色溶液中可能有SO42-、OH-、CO32-、Cl-等阴离子中的一种或几种。
(1)若该溶液中还存在相当浓的H+,则溶液中可能含有的阴离子是 (多写要扣分)
(2)若该溶液中还存在较多量的Ba2+,则溶液中可能含有的阴离子是 (多写要扣分)
31(6分)a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:![]()
其中: a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
⑴如果a是一种淡黄色粉末固体,试推断这五种物质。用名称表示:
a ;c ;e 。
 ⑵如果a是一种常见气体,试推断这五种物质。用化学式表示:
⑵如果a是一种常见气体,试推断这五种物质。用化学式表示:
a ;c ;e 。
三、(本题包括3小题;共14分)
32(7分)喷泉是一种常见的自然现象,其产生原因是存在压强差。
⑴右上图为化学教学中用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是
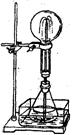 A.HCl和H2O B.O2和H2O
C.NH3和H2O D.CO2和NaOH溶液
A.HCl和H2O B.O2和H2O
C.NH3和H2O D.CO2和NaOH溶液
⑵某学生积极思考产生喷泉的其他办法,并设计了如右下图所示的装置。
①在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
②在右下图锥形瓶外有一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是
③比较右上图和右下图两套装置,从产生喷泉的原理来分析,右上图是 上部烧瓶内气体压强;右下图是 下部锥形瓶内气体压强。
 ⑶常见的人造喷泉及火山爆发的原理与上述 (填右上图或右下图)装置的原理相似。
⑶常见的人造喷泉及火山爆发的原理与上述 (填右上图或右下图)装置的原理相似。
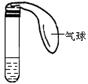
33(4分)某学生课外活动小组利用右图所示装置分别做如下实验:
⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是: 。
⑵在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
溶液;加热时溶液由无色变为红色的原因是: 。
34(3分)试简要回答下列问题
⑴焰色反应操作可简要地用五个字表示“洗、烧、醮、烧、洗”,第一个“烧”的作用是
;
⑵配制200mL0.1mol·L-1氯化钠溶液时必不可少的玻璃仪器是 ;
⑶酒精不能用于萃取碘水中的碘,其原因是 。
四、(本题有2个小题,共10分)
35(4分)某硫酸试剂瓶的标签上写着:密度为1.84g·cm-3,质量分数为98%。试计算:
⑴该硫酸溶液中硫酸的物质的量浓度是多少?
⑵要多少毫升这种浓硫酸才能配制100mL1.84mol·L-1硫酸溶液?
36(6分)用1L 1.0 mol·L-1 NaOH溶液吸收17.92L CO2(标准状况)后溶液体积不变。求所得溶液中的CO32-和HCO3-的物质的量浓度。
(已知可能的反应为:2NaOH+ CO2== Na2CO3+H2O,NaOH+ CO2==NaHCO3)
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | B | D | D | A | D | D | C | B | C | B | C | A |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 答案 | C | A | C | A | B | C | A | A | C | D | B | B | D |
27(4分)
⑴ 2NaCl + 2H2O![]() 2NaOH +
Cl2 + H2↑
2NaOH +
Cl2 + H2↑
⑵ Cl2+2OH- == Cl- + ClO- + H2O
⑶ Fe3+ + 3SCN- == Fe(SCN)3
28(8分)
⑴![]() 16.7%; 5:1 ; 氧化性和还原 性; 0.2mol
16.7%; 5:1 ; 氧化性和还原 性; 0.2mol
⑵ CuSO4·5H2O ; Cu2(OH)2CO3 ; Kal(SO4)2·12H2O 。
29(4分)
氧化性: Cl2>Br2>I2 还原性:I->Br->Cl- 活动性: Cl2>Br2>I2
30(2分)
(1)SO42-、Cl- (2)OH-、Cl-
31(6分)
⑴a 硫 ;c 二氧化硫 ;e 硫酸 。⑵a N2 ;c NO2 ;e HNO3 。
32(7分)
⑴B; ⑵①C、D; ②A,浓硫酸溶解放热使锥形瓶内气体受热膨胀,使锥瓶内气体压强大于烧瓶,酒精喷入烧瓶形成喷泉 ③大气压强大于; 烧瓶内氧化压强小于。 ⑶ 右下图。
33(4分)
⑴加了酚酞的氨水 ; 加热时氨挥发使氨水浓度变小碱性减弱,溶液红色变浅 。
⑵ 通了二氧化硫的品红溶液; 无色化合物不稳定,受热分解重新生成品红和二氧化硫 。
34(3分)
⑴ 除去杂质 ;⑵200mL容量瓶 ;⑶酒精与水互溶 。
35(4分)
⑴18.4 mol·L-1 ⑵10mL
36(6分)
C(CO32-)=0.2 mol·L-1 C(HCO3-)=0.6 mol·L-1