高一化学(综合题)检测题
命题人:af 学号________. 姓名________.
第Ⅰ卷(选择题)
一.选择题 (请将你认为正确的答案代号填在Ⅱ卷的答题栏中,本题共18小题)
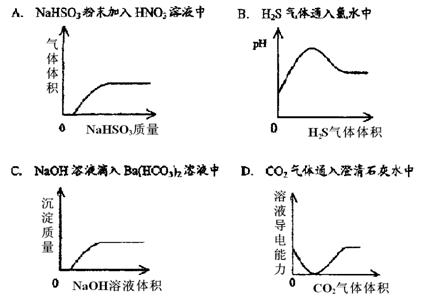
1. 下列实验室中分离或除杂质的方法中不正确的是
A.用升华法分离碘和碘化钠固体混合物 B.用加热法除去氯化钙中混有的氧化铵
C.用蒸馏法分离乙醇和丁醇混合物 D.用萃取法除去溴苯中混有的溴单质
2. 下列实验中用错试剂的是
A.用热碱液清洗做过油脂实验的试管 B.用碱石灰吸收氨气中的水蒸气
C.用酒精萃取碘水中的碘 D.用酒清浸泡试管中残留的少量酚醛树脂
3. 下列物质的性质比较,正确的是
A.热稳定性:Na2CO3>NaHCO3>H2CO3
B.熔点:K>Na>Li
C.溶解度:NaHCO3>Na2CO3
D.氧化性:K+>Na+>Li+
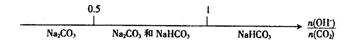
4. 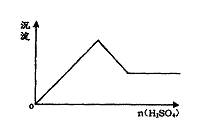 向一无色透明的溶液中滴加稀硫酸时有沉淀生成且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
向一无色透明的溶液中滴加稀硫酸时有沉淀生成且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
A.Na2SiO3与Na2CO3的混合溶液
B.NaAlO2与Na2S2O3的混合溶液
C.AlCl3与CuSO4的混合溶液
D.AlCl3与Na2S的混合溶液
5. 下列有关比较中,大小顺序排列错误的是
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰>汞
C.结合H+的能力:CO32->CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
6. a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生下图所示转化,其中a是单质;b在通常状况下是气体;c、d都是氧化物;e是该元素的最高价氧化物对应水化物,且是一种强电解质;则a可能是
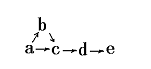 (1)Cl2 (2)N2 (3)S (4)C
(1)Cl2 (2)N2 (3)S (4)C
A(1)(2) B(2)(3) C(3)(4) D(2)(4)
7. 下列有关实验室一般事故的预防和处理方法正确的是
A.燃着的酒精灯打翻失火,应立即用水浇灭
B.少量酸或碱滴到实验台上,立即用湿抹布擦净,再用水冲洗抹布
C.金属钠着火时,可用干粉灭火器来扑灭
D.蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却
8. 下列分离或提纯物质的方法错误的是
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
9. 以石灰石、食盐、焦炭、水和空气为主要原料,不能生产的化工产品是
A.漂白粉 B.烧碱 C.硝酸铵 D.玻璃
10. 以下命题,违背化学变化规律的是
A.石墨制成金刚石 B.煤加氢变成人造石油
C.水变成汽油 D.电解法制氟气
11. 下列有关化学用语表述正确的是
A.H2O与D2O互为同素异形体
B.18克水(H2O)中氧元素物质的量为1 mol
C.含1 mol 碳原子的金刚石中有4 mol 的共价键
D.1 mol 过氧化钠中含2 mol 阴离子
12. 下列化学名词正确的是
A.三溴笨酚 B.乙稀 C.乙酸乙酯 D.石炭酸
13. 下列化合物不能通过化合反应获得的是
A.CuS B.Na2O2
C.Fe(OH)3 D.NaHCO3
14. 实验室制取下列气体,方法正确的是
A.硫化氢:在启普发生器内用硫铁矿与稀硝酸制取,排饱和硫氢化钠溶液法收集
B.甲烷:将醋酸钠晶体和氢氧化钠混合加热,并用排水法收集
C.氨:将消石灰和氯化铵加热,并用向下排空气法收集
D.二氧化碳:用CaCO3和稀H2SO4反应,并用向下排空气法收集
15. 将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下列知识正确的是
A.硫及其化合物的化合价与氧化还原反应的关系:

B.分散系的分类:
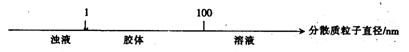
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
![]()
D.CO2与NaOH溶液反应后的产物
16. 下列实验过程中产生的现象与对应的图形相符合的是
|
17. 下列各种物质中按熔、沸点由低到高顺序排列正确的是
A.O2 I2 Hg B.CO2 KCl SiO2
C.Na K Rb D.SiC NaCl SO2
18. 实验室有下列试剂:NaHSO4、MnO2、KCl、Na2O2、H2O、Zn,欲制取HCl、Cl2、O2、H2,其中不合理的组合是
A.制Cl2:MnO2、KCl B.制HCl:NaHSO4、KCl
C.制O2:H2O、Na2O2 D.制H2:NaHSO4、H2O、Zn
第Ⅱ卷(非选择题 共3道简答题2道实验题2道计算题
请将你认为正确的答案代号填在下表中
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | ||||||||||||
二.简答题 (共3小题)
19. 如图中C至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气体,X、Y是常见的金属单质.W是由甲、乙两种元素按1∶1组成,其中甲元素的原子M层电子数是K层的一半.乙元素的原子最外层电子数是次外层电子数的3倍,参加反应的水和生成的水已从图中略去.
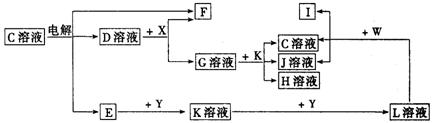
填写下列空白:
(1)E是______(化学式),Y元素在周期表中的位置是__________________.
(2)用电子式表示W的形成过程__________________________________________.
(3)写出K+G→H+J+C的离子方程式____________________________________.
(4)设计实验分离H和J(写出加入试剂和操作方法):________________________.
20. 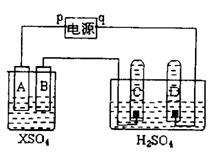 图中p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生云泡。试回答:
图中p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生云泡。试回答:
⑴p为_______极,A极发生了______________反应;
⑵C为_______极,试管里收集到______________;
D为_______极,试管里收集到______________;
⑶C极的电极方程式是:_____________________;
⑷在电解过程中,测得了C、D两极上产生的气体的实验数据如下:
| 时间 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阴极生成气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出可能的原因是:___________________________________
_____________________________________________________________________________
_____________________________________________________________________________
⑸当反应进行一段时间后,A、B电极部附近溶液的pH_______ (填增大、减小或不变);
⑹µ电路中通过0.0004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩质量为
____________________________。
21. (1)某学生的实验报告中有下列数据:
①用托盘天平称取11.7g氯化钠; ②用100mL的量筒量取21.48mL盐酸;
③用容量瓶配制480mL 1mol/L的氯化钠溶液;
④用酸式滴定管量取25.00mL硫酸溶液;
⑤用pH试纸测定H2SO4溶液的pH为3.2。其中合理的是
A.只有①④ B.只有②④ C.只有①③ D.只有②⑤
(2)向鸡蛋白水溶液中加入少量的 (填一种试剂),再 (填实验操作名称)可得到较纯的鸡蛋白固体
(3)鉴别苯、苯酚、1-己烯、四氯化碳、碘化钠溶液,应选用的试剂是
三.实验题 (共2小题)
22. 请按要求填空:
(1)下列实验操作或对实验事实的叙述正确的是 (填序号)
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO4溶液;
④用托盘天平称取10.50 g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
(2)为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,
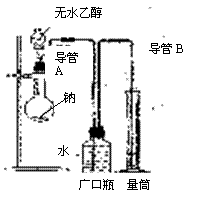 并据此计算乙醇分子中能与金属钠反应的氢原子的数目。
并据此计算乙醇分子中能与金属钠反应的氢原子的数目。
试回答下列问题:
①指出实验装置中的错误
②若实验中用含有少量水的乙醇代替相同质量的无水
乙醇,相同条件下,测得的氢气体积将
(填“偏大”、“偏小”或“不变”)
③请指出能使该实验安全、顺利进行的关键实验步骤
(至少指出两个关键步骤)
。
23. 超细氮化铝粉末被广泛应用于大规模集成电路生产领域。其制取原理为:
Al2O3+3C+N2-→2AIN+3CO
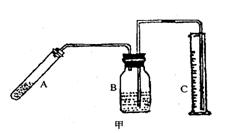 由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成份的含量,进行了以下两个实验:
由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成份的含量,进行了以下两个实验:
⑴称取10.00g样品,将其加入过量的氢氧化钠溶液中,装置见
右图甲,AIN跟氢氧化钠溶液反应生成NaAIO2,并放出氨气
3.36L(标准状况)。
①上述反应的化学方程式为 。
②该样图中的AIN的质量分数为 。
③在装置B中所选择的试剂是
(填序号)。
a.H2O b.浓H2SO4 c.CCl4 d.饱和食盐水
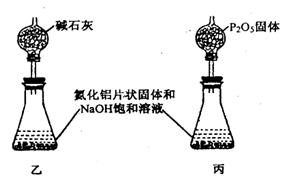
|

⑵另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g•L-1(已折成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g.
四.计算题 (共2小题)
24. 将某温度下的KNO3溶液200g蒸发掉10g水,恢复到原温度,或向其中加入10gKNO3固体,均可使溶液达到饱和。试计算:
(1)该温度下KNO3的溶解度。
(2)原未饱和溶液中溶质的质量分数。
25. 已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
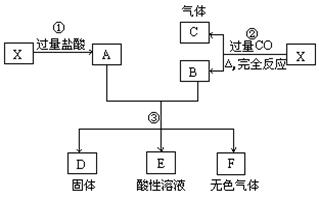 |
(1)写出①、②和③步所有反应的化学方程式;
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X的质量和X中FeO与CuO的质量比。
高一化学(综 合 题)检测题
参考答案(仅供参考)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | C | A | B | A | B | B | C | D | C | B | D | A | C | C |
| 16 | 17 | 18 | ||||||||||||
| D | B | A |
二.简答题答案:
19. (1)![]() ,四周期Ⅷ族 (2)
,四周期Ⅷ族 (2) ![]()
(3)![]()
| |
20. ⑴正极 氧化 ⑵阳极 氧气; 阴极 氢气。
⑶4OH--4e-==2H2O+O2↑
⑷在开始反应的1--4分钟内,由于生成的氧气和氢气在水中溶解没有达到饱和,氧气的溶解度大于氢气,故氢气和氧气体积比大于2:1,随着反应的进行,到4分钟后,由于生成的氧气和氢气在水中溶解均达到饱和,故体积比等于2:1。
⑸不变 ⑹64g·mol-1
21. (1)A. (2分) (2)饱和(NH4)2SO4溶液,(2分)过滤、洗涤(2分)
(3)浓溴水(2分)
三.实验题答案:
22. (1)①②⑤⑧
(2)①广口瓶中进气导管不应插入水中,排水导管应插至广口瓶底部
②偏大
③检查实验装置的气密性;加入稍过量的金属钠;从漏斗中缓慢滴加无水乙醇。
23. ⑴①AlN+NaOH+H2O=NaAlO2+NH3 (3’)
②0.615 (3’)
③C (3’)
④乙 (3’)
⑵1.92 (5’)
四.计算题答案:
24. (1)该温度下KNO3的溶解度为100g (3分)
(2)原来饱和溶液中溶质的质量分数为47.5%
蒸发掉10gH2O得到190g饱和溶液,根据溶解度其溶质为95g。故原来饱和溶液中溶质的质量分数为![]()
(或加10gKNO3得到210g饱和溶液,其溶质为105g。故原来饱和溶液中溶质为95g,质量分数为![]() )
)
25. 1.(1)CuO+2HCl == CuCl2+H2O,FeO+2HCl == FeCl2+H2O
(2)CuO+CO == Cu+CO2, FeO+CO == Fe+CO2
(3)Fe+CuCl2 == Cu↓+FeCl2,Fe+2HCl == FeCl2+H2↑
2.![]() , 80 g/mol×0.25 mol == 20 g(CuO)
, 80 g/mol×0.25 mol == 20 g(CuO)
![]() , 0.25 mol+0.25 mol == 0.5 mol(Fe)
, 0.25 mol+0.25 mol == 0.5 mol(Fe)
0.5 mol×72 g/mol == 36 g(FeO)
则X的质量为56 g,FeO与CuO的质量比为9:5