高一化学第一学期期中试卷
化 学
命题人:蔡重庆 校对人:董燕
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
可能用到的相对原子质量:H-1、C-12、O-16、Na-23、Mg-24、S-32、Cl-35.5、
K-39。
第I卷(选择题共20小题、共40分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.某同学将浓硫酸、NaOH固体、碱石灰、P2O5固体等物质划分为一类。该同学的分类依据为
A.酸类 B.碱类 C.干燥剂 D.氧化物
2.从碘水中提取碘可以采用的方法是
A.萃取 B.沉淀 C.蒸馏 D.过滤
3.下列物质在一定条件下能够导电,但不属于电解质的是
A.铝 B.食盐 C. 硫酸 D. 蔗糖
4.用特殊的方法把固体物质加工到纳米级(1~100nm,1nm=10-9m)的超细粉末,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是
A.溶液 B.悬浊液 C.胶体 D.乳浊液
5.关于钠元素的单质及其化合物的叙述不正确的是
A.钠,银白色,质软,熔点相对较低,密度比水小。
B.大量的钠着火时可以用沙扑灭,少量的钠应保存在煤油中。
C.金属钠在空气中长期放置,最终变为碳酸钠。
D.氧化钠和过氧化钠都是白色固体,都是碱性氧化物。
6.粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。
①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
A.③②①⑤④ B.②③①④⑤ C.①③②⑤④ D.③⑤②①④
7.我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
8.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.K+、Ba2+、HCO3-、NO3-
9.实验室用MnO2催化KClO3分解制氧气,要分离提纯回收其中的MnO2进行的操作为
A.溶解、过滤、蒸发 B.溶解、过滤、洗涤、干燥
C.溶解、过滤、结晶 D.溶解、结晶、干燥
10.对于反应:TiCl4+4Na==4NaCl+Ti,下列说法正确的是
A.该反应说明钠是强还原剂,可用于冶炼金属 B. Ti是氧化产物
C.该反应条件是TiCl4在熔融状态或水溶液中 D.TiCl4是还原剂
11.下列物质只能作还原剂的是:
A.S2- B.Fe2+ C.Fe3+ D.H+
12.不能用离子方程式:CO32—+2H+===CO2↑+H2O来表示的反应是
A.K2CO3+H2SO4 B.Na2CO3+HCl C.Na2CO3+HNO3 D.Na2CO3+CH3COOH
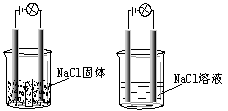 13.一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是
13.一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是
A.NaCl是非电解质
B.NaCl溶液是电解质。
C.NaCl在水溶液中电离出了可以自由移动的离子。
D.NaCl溶液中水电离出大量的离子
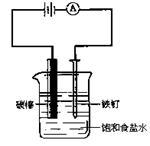 14.如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是
14.如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是
A.Cl2 B.O2 C.H2 D.HCl
15.1966年,范克(Fwnk.J.E)等人提出热化学循环制氢法:
![]()
![]()
![]() 从理论上讲,该循环中,1 mol
从理论上讲,该循环中,1 mol![]() 能制氢气
能制氢气
A.0.25 mol B.0.5 mol C.1 mol D.2 mol
16.若上题中电解的是未精制的饱和食盐水,结果很快在某一电极附近出现浑浊现象。造成浑浊的难溶物主要是
A.碳酸镁 B.硫酸钡 C.氢氧化镁 D.碳酸钡
17.下列有关Na2CO3和NaHCO3性质的比较中,正确的是
A.热稳定性:Na2CO3<NaHCO3
B.与稀盐酸反应的快慢:Na2CO3>NaHCO3
C.106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3
D.常温时水溶性:Na2CO3>NaHCO3
18. 能正确表示下列化学反应的离子方程式是
A.氢氧化钡溶液与稀硫酸的反应OH-+H+=H2O
 B.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2↑
阅读、分析下列两个材料:
材料一、 (见右图)
材料二、
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以 任意比互溶 |
回答19~20题(填写序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
19.将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用__________。
20.将乙二醇和丙三醇相互分离的最佳方法是__________。
第II卷(非选择题,共60分)
二、填空题(本大题包括5小题,共32分)
21.(4分)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)⑥KNO3溶液 填空回答(填序号):
(1)以上物质能导电的是 ▲ ;
(2)以上物质中属于电解质的是 ▲ ;
(3)以上物质中属于非电解质的是 ▲ ;
22.(6分)用双线桥标出下列反应中电子转移的方向和数目,并指出氧化剂和还原剂。
(1)Cl2 + SO2 + 2H2O = H2SO4 + 2HCl
氧化剂 ▲ ,还原剂 ▲ ;
![]() (2)MnO2 + 4HCl(浓) == MnCl2 + Cl2↑+ H2O
(2)MnO2 + 4HCl(浓) == MnCl2 + Cl2↑+ H2O
氧化剂 ▲ ,还原剂 ▲ 。
23.(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
▲ ;
(2)漂白粉的有效成分是(填化学式) ▲ ;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 ▲ ;
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) ▲ ;
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈 ▲ 性,并可能具有
▲ 性。
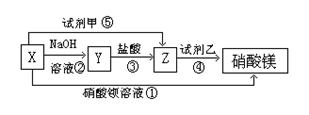 24.(10分) X、Y、Z三种物质有如图所示转化关系:
24.(10分) X、Y、Z三种物质有如图所示转化关系:
(1)根据上述转化关系,写出下列物质的 化学式:X ▲ 、Y ▲ 、
Z ▲ 、试剂甲 ▲ ,
试剂乙 ▲ ;
(2)写出上述各步反应①~⑤的离子方程式:
① ▲ ;② ▲ ;③ ▲ ;
④ ▲ ;⑤ ▲ 。
25.(4分)根据物质的组成对物质进行分类,请将:均匀混合物、非均匀混合物、有机化合物、无机化合物、单质、化合物、金属单质、非金属单质,填入下图的方框中。
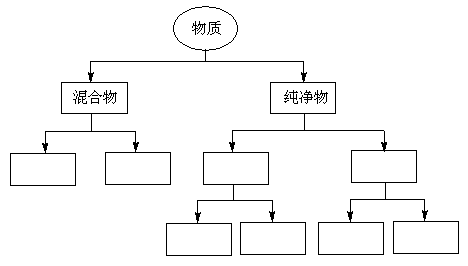 |
三、实验题(本大题包括2小题,共16分)
26.(8分)某学生设计了如下实验:
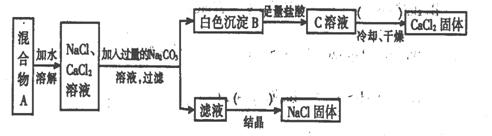 |
回答下列问题:
(1)该同学的实验目的是 ▲ ;
(2)上图括号内的操作步骤均为 ▲ ;
(3)按此实验方案得到的NaCl固体中肯定含有 ▲ (填化学式)杂质;
为了解决这个问题可以向过滤得到的滤液中加入适量的 ▲ ;
(4)写出生成B的离子方程式 ▲ 。
27.(8分)实验室欲配制80mL 2mol/L的KCl溶液,就配制该溶液的过程,请回答:
(1)不需要的仪器是 ▲ ;
A.烧杯 B.100mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F. 50mL容量瓶
(2)配制时应称取KCl ▲ g;
(3)下列操作的顺序是(用字母表示) ▲ ;
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
 (4)若容量瓶未干燥即用来配制溶液,实验结果将 ▲ ,若定容时俯视刻度线,实验结果将 ▲ 。
(4)若容量瓶未干燥即用来配制溶液,实验结果将 ▲ ,若定容时俯视刻度线,实验结果将 ▲ 。
四、计算题(本大题包括2小题,共12分)
28.(6分)试求相同质量的SO2和SO3所含硫原子的个数比(必须写出解题过程)。
29.(6分)右图是“康师傅”牌饮用矿泉水的标签的部分内容。请认真阅读标签内容,计算:
(1)镁离子的物质的量浓度的最大值。
(2)一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过多少?(单位:mol)
2006学年杭七中第一学期高一期中评分标准()
化 学
 第I卷(选择题,共40 分)
第I卷(选择题,共40 分)
一、选择题(每小题只有一个选项符合题意,共40分)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | A | C | D | A | B | C | B | A |
| 题序 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | D | C | A | C | C | D | D | C | A |
|
第II卷(非选择题,共60分)
二、填空题(本大题包括5小题,共32分)
21.(4分)(1)3、6 (2)1、2、5(3)4;
|
![]() (1)
(1)
![]() Cl2
+ SO2 + 2H2O = H2SO4 + 2HCl
Cl2
+ SO2 + 2H2O = H2SO4 + 2HCl
|
氧化剂: Cl2 , 还原剂: SO2 ;
|
![]()
![]() MnO2
+ 4HCl(浓) == MnCl2 + Cl2↑+ H2O
MnO2
+ 4HCl(浓) == MnCl2 + Cl2↑+ H2O
|
氧化剂: MnO2 , 还原剂: HCl
23.(8分) (1)2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
(2)Ca(ClO)2
(3)Ca(ClO)2 + CO2 + H2O == CaCO3↓+ 2 HClO
(4) (1) (5)碱性 强氧化性
24.(10分) X: MgSO4 Y : Mg(OH)2 Z: MgCl2 甲:BaCl2 乙:AgNO3
① SO42- +Ba2+ =BaSO4↓ ② Mg2+ +2OH- = Mg(OH)2↓
③ Mg(OH)2 +2H+ = Mg2+ +2H2O ④ Ag+ + Cl- =AgCl↓
⑤ SO42- +Ba2+ =BaSO4↓
25.(4分)略
三、实验题(本大题包括2小题,共16分)
26.(8分)(1)分离CaCl2和NaCl两种固体混合物; (2)蒸发
(3)Na2CO3 稀盐酸 (4)Ca2++CO32-=CaCO3↓
27.(8分)(1) F (C F) 。(2) 14.9 g。(3) B E A G C (F) D F 。
(4) 无影响 , 偏大 。
四、计算题(本大题包括2小题,共12分)
28.(6分) 5 :4
29.(6分)(1)2.04×10-4mol/L;(2)7.11×10-5mol