 高一化学模拟题3
高一化学模拟题3
【主题】 期末1-4章模拟检测
模拟检测3
1.实验室制取下列各组气体,所用气体发生装置相同的是 A
A.氢气和二氧化碳 B.氢气和氧气
C.氯气和氧气 D.氯气和氢气
2. 如图所示装置,试管中盛有水,气球a中盛有干燥的Na2O2颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口。实验时将气球a中的Na2O2抖落到试管b的水中,将发生的现象是 C
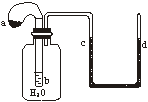
A. U形管内红水褪色 B. 试管内溶液变红
C. 气球a被吹大 D. U形管水位不变
3. 欲完成“A→A-”的变化,所选用的试剂应满足的条件是 A
A. 还原性比A-强 B. 酸性比A弱
C. 氧化性比A强 D. 还原性比A-弱
4.某烧碱溶液中含有少量杂质纯碱,要除去此杂质需要加适量的下列试剂 C
A.CaCl2溶液 B.Ba(NO3)2溶液
C.Ca(OH)2溶液 D.稀盐酸
5. 取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是 B
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色
D.Ⅳ中溶液不分层,溶液由棕黄色变成黄绿色
6.下列离子方程式书写正确的是 C
A.碳酸氢钠与醋酸反应:HCO3-+H+==CO2↑+H2O
B.锌与盐酸反应:Zn+2H++2Cl-==Zn2++2Cl-+H2↑
C.二氧化锰与浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.钾与水反应:K+2H2O==K++2OH-+H2↑
7.关于碳酸钠和碳酸氢钠的叙述中,正确的是D
A.相同物质的量的两种盐与盐酸反应时,后者消耗盐酸多
B.相同质量的两种盐与足量盐酸反应时,前者生成的CO2多
C.相同质量的两种盐与足量盐酸反应时,前者反应剧烈
D.两种溶液与澄清石灰水反应时,均生成白色沉淀
8. 将100mL 0.6mol/L的盐酸和等体积0.4mol/L的Ba(OH)2溶液混合后,所得混合液的体积为二者之和,则混合液中OH-离子物质的量浓度是 A
A.0.1mol/L B.0.2mol/L C.0.4mol/L D.0.05mol/L
9.下列物质见光易分解的是 D
①溴化银;②氟化钙;③氯水;④漂白粉;⑤碘化钾;⑥碘化银
A.①②③ B.④⑤⑥ C.①③④ D.①③⑥
10.下列有关气体体积的叙述中,正确的是 B
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体的摩尔体积是指1mol任何气体所占的体积为22.4L
11.下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是 D
A.Cu(OH)2+HCl与Cu(OH)2+CH3COOH B.NaHCO3+H2SO4与Na2CO3+HCl
C.NaHCO3+NaOH与Ca(HCO3)2+NaOH D.BaCl2+H2SO4与Ba(OH)2+Na2SO4
12.下列反应中,Na2O2只表现强氧化性的是 B
A.2Na2O2+2CO2 2Na2CO3+O2
B.Na2O2+MnO2==Na2MnO4
C.5Na2O2+2MnO4-+16H+==10Na++2Mn2++5O2↑+8H2O
D.2Na2O2+2H2SO4==2Na2SO4+2H2O+O2↑
13. 0.5升1摩/升FeCl3溶液与1.5升1摩/升KCl溶液混合,混合液中Cl-的物质的量浓度(假设混合时溶液的体积不变) C
A. 1摩/升 B. 2摩/升 C. 1.5摩/升 D. 3摩/升
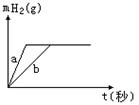 14.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,
14.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,
则下列说法中正确的是 A
A.曲线a为K,b为Na
B.投入的Na的质量大于K的质量
C.投入的Na、K一定等质量
D.稀盐酸的量一定是不足量的
15. 质量分别为12g的石墨、金刚石在某一相同条件下燃烧生成同一产物时分别放出的热量为393.8kJ、395.2kJ,金刚石和石墨比较,能量“贮存”高的是: B
A.石墨 B.金刚石 C.一样高 D.无法判断
16. 鉴别下列各组物质中,只能采用焰色反应的是 D
A. K2CO3和NaCl B. KCl和NaNO3 C. NaCl和MgCl2 D. NaCl和KCl
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17. 实验室用碳酸钠晶体(Na2CO3•10H2O)配制1.00 mol/L的Na2CO3溶液100mL,回答下列问题:
⑴所需主要仪器为:药匙、托盘天平、烧杯、量筒、 玻璃棒 、 100mL容量瓶 和胶头滴管;
⑵本实验须称量碳酸钠晶体(Na2CO3•10H2O) 28.6 g。
⑶容量瓶上标有:刻度线(标线)、 温度 、容量(体积) 。
⑷某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后直接倒进所选的且经检查不漏水的容量瓶中,洗涤烧杯2—3次,洗涤液也移至容量瓶中,晃动容量瓶使其混合均匀,然后加水至离刻度线2cm处,用胶头滴管加水至刻度线,倒入试剂瓶贴上标签备用。请指出上述操作中的两处明显错误:
① 直接倒入容量瓶中,而应用玻璃棒引流
② 定容后没有将容量瓶倒转摇匀
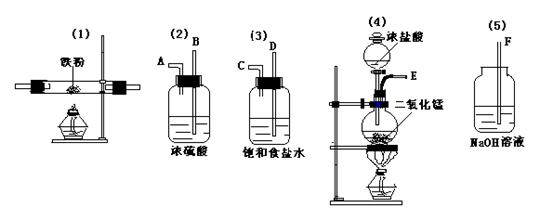
![]() 18.中用下列仪器和药品来制取纯净的无水FeCl3,图中的A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出。
18.中用下列仪器和药品来制取纯净的无水FeCl3,图中的A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出。
① 如果所制气体从左到右流向,上述各仪器装置正确连接顺序是(填序号)
( )接( )接( )接( )接( ); 其中 ⑵与⑶装置相连时,玻璃管口应是
接 (填字母)
②装置⑵的作用是 ;装置⑶的作用 ;装置⑸发生反应的离子方程式 。
③实验开始时,应首先检验装置 ;实验结束应先熄灭 处的酒精灯。
④装置⑷发生的化学方程式 。
⑤写出装置⑴中发生的化学方程式 。
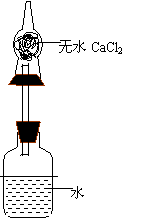 19.为了测定某碱金属的相对原子质量,设计的实验装置如右图,整个装置、 (包括广口瓶中的水,干燥管内的干燥剂无水CaCI2)的总质量为480.00g ,将质量为1.38g某碱金属投入水中,立即塞紧瓶塞,反应完毕后整个装置、溶液的总质量为481.32g。试回答下列问题:
19.为了测定某碱金属的相对原子质量,设计的实验装置如右图,整个装置、 (包括广口瓶中的水,干燥管内的干燥剂无水CaCI2)的总质量为480.00g ,将质量为1.38g某碱金属投入水中,立即塞紧瓶塞,反应完毕后整个装置、溶液的总质量为481.32g。试回答下列问题:
![]()
![]() (1)该金属的相对原子质量是
,元素符号是
;
(1)该金属的相对原子质量是
,元素符号是
;
(2)装置中干燥管的作用是 。
(3)若没有干燥管,则测得的该金属的相对原子质量的结果,将比实际 。(填偏大、偏小或不影响)
20.实验可用高锰酸钾与浓盐酸反应制氯气,该反应的化学方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O 。①将7.9 g高锰酸钾与50 mL12 mol/L盐酸反应可制得多少升氯气(标准状况)?②若往反应后的溶液中加入足量的硝酸银溶液,可生成多少克氯化银沉淀?
17
⑴ 玻璃棒 、 100mL容量瓶 ; (只答“容量瓶”0分);
⑵ 28.6 g。
⑶刻度线(标线)、 温度 、容量(体积) 。
⑷① 直接倒入容量瓶中,而应用玻璃棒引流 ;②定容后没有将容量瓶倒转摇匀 。
18.
(1) ( 4 )接( 3 )接( 2 )接( 1 )接( 5 ); C 接 B
(2) 干燥Cl2 、 除杂(HCl) 。
Cl2+2OH-=Cl-+ ClO-+H2O
(3) 气密性 、 (1) 。
加热
(4) MnO2+4HCl(浓)=====MnCl2+ Cl2+↑+2 H2O
(5) 加热
3Fe+2Cl2===== FeCl3
19.
(1) 23 、 Na 。
(2) 吸收H2带走的水分 。
(3) 偏小 。
20.
△
(1) 2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
2mol 16 mol 5mol
7.9/158=0.05mol 12×0.05=0.6mol x=0.125mol
所以HCl过量,以KMnO4的量来计算
V(Cl2)=o.125mol×22.4L=2.8L
(2) 根据氯元素守恒: Cl-————AgCl
1mol 143.5g
0.6-0.125×2=0.35mol y=50.225g