高一化学上期期末检测试卷
命题:李会良(永州一中) 盘明娟(永州四中)
审题:唐柏青(永州市教育科学研究中心)
| 题 号 | 一 | 二 | 三 | 四 | 总 分 | 合分人 | 复分人 |
| 得 分 |
|
|
|
|
|
|
|
考生注意: 1.本套试卷包括四道大题,共25道题,满分100分,时量90分钟。
2.可能用到的相对原子质量数据:H 1 C 12 O 16 Cl 35.5 Cu 64
| 阅卷人 |
|
| 得 分 |
|
一、选择题(本题包括18小题,每小题只有一个正确答案,每小题3分,共54分。请将每小题正确答案的序号填入下表答题栏内)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
1.硅被誉为无机非金属材料的主角。下列物品用到硅单质的是
A.陶瓷餐具 B.石英钟表 C.计算机芯片 D.光导纤维
2.下列物质不属于“城市空气质量日报”报道内容的是
A.二氧化硫 B.氮氧化物 C.悬浮颗粒 D.二氧化碳
3.某二价阳离子含24个电子,它的质量数为56,则该离子核内中子数是
A.24 B.30 C.32 D.34
4.将少量氯水加入盛有KBr溶液的试管中,再加入适量的汽油,然后振荡,静置,产生的现象是
A.溶液呈橙色
B.溶液呈无色
C.上层液体呈橙色,下层液体几乎无色
D.上层液体呈紫红色,下层液体几乎无色
5.下列物质中,既含有离子键又含有非极性键的是
A.CO2 B.MgCl2 C.H2O2 D.Na2O2
6.下列溶液中,Na+物质的量浓度最大的是
A.1mL 0.5mol·L-1的NaNO3溶液 B.100mL 0.01mol·L-1的NaCl溶液
C.10mL 0.1mol·L-1的NaOH溶液 D.100mL 0.1mol·L-1的Na2SO4溶液
7.储存浓H2SO4 的铁罐外口会出现严重的腐蚀现象,这体现浓H2SO4的
A.吸水性和酸性 B.脱水性和吸水性
C.强氧化性和吸水性 D.不挥发性和酸性
8.根据下列反应:2Fe3++2I-=2Fe2++I2 ,Br2+2Fe2+=2Br-+2Fe3+ 。判断离子的还原性由强到弱的顺序是
A.Br->Fe2+>I- B.I->Fe2+>Br-
C.Br->I->Fe2+ D.Fe2+>I->Br-
9.下列化学用语表述正确的是
 | |||
A.F-的结构示意图 B.H2O的电子式
![]()
![]() C.NaCl的电子式 D.Cl2的结构式
C.NaCl的电子式 D.Cl2的结构式
10.在无色透明的溶液中可以大量共存的离子组是
A.H+、K+、OH-、SO42- B.Na+、K+、H+、HCO3-
C.Cu2+、Ba2+、OH-、Cl- D.Mg2+、K+、Cl-、NO3-
11.有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b;阴离子所带负电荷数c>d。则四种元素的原子序数关系是
A.a>b>c>d B.b>a>d>c C.c>d>a>b D.b>a>c>d
12.NA表示阿伏加德罗常数,下列叙述中正确的是
A.1mol氦气含有的原子数NA
B.22gCO2气体所含有的分子数为NA
C.标准状况下,11.2LSO3中含有的氧原子数为1.5 NA
D.常温常压下,22.4LH2含有的分子数为NA
13.下列关于物质性质的比较, 不正确的是
A.还原性强弱:F->Cl->I-
B.原子半径大小:Se>S >O
C.碱性强弱:NaOH >Mg(OH)2 >Al(OH)3
D.气态氢化物稳定性强弱:PH3<H2S<HCl
14.下列离子方程式书写正确的是
A.二氧化硫与水反应:SO2+H2O=2H++SO32-
B.铁和稀硫酸反应:Fe+2H+=Fe2++ H2 ↑
C.稀硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.钠投入水中:Na+2H2O=Na++2OH-+H2 ↑
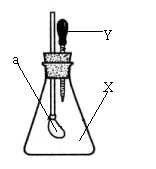 15.如右图所示,锥形瓶内盛有干燥的气体X,胶头滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能的是
15.如右图所示,锥形瓶内盛有干燥的气体X,胶头滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能的是
A.X是Cl2,Y是NaOH溶液
B.X是HCl,Y是NaCl的稀溶液
C.X是SO2,Y是NaOH溶液
D.X是CO2,Y是稀硫酸
16.某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是
A.一定存在HCl B.一定存在SO2
C.肯定没有CO2 D.不能肯定是否含有HI
17.过氧化氢(H2O2),既有氧化性又有还原性,H2O2和稀硫酸酸化的KMnO4溶液反应如下:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O。如果H2O2中的氧原子是示踪原子
(18 8O),当反应完成后,含有示踪原子的物质是
A.O2 B.H2O C.MnSO4 D.K2SO4
18.用mgCu与足量的浓硫酸共热,当反应完毕后,生成VL二氧化硫气体,则被还原的硫酸
A.49V/5.6 mol B.m/64 mol C.V/22.4 mol D.V/11.2 mol
| 阅卷人 |
|
| 得 分 |
|
二、填空题(本题包括4道题,共26分)
19.(4分)过氧化钠是一种重要的化合物,常用作呼吸面具中和潜水艇的供氧剂,其化学式为 ,它与二氧化碳反应的化学方程式为 。
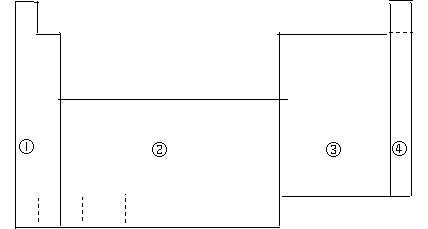
20.(10分)下图所示,①、②、③、④代表元素周期表中的四个区域,请回答下列问题:
|
| ||||||||||||||||
| ||||||||||||||||
| ||||||||||||||||
(1)元素周期表中全部是金属元素的区域是__________(填写编号)。
![]() (2)在元素周期表中,在金属元素与非金属元素的分界线附近可以找到_________。
(2)在元素周期表中,在金属元素与非金属元素的分界线附近可以找到_________。
A.催化剂 B.制造农药的元素
C.半导体材料 D.耐高温、耐腐蚀的合金材料
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化物薄膜,乙元素原子核外M层与K层的电子数相等。则
①甲元素为_________(填元素符号)。
②甲、乙两元素相比较,金属性较强的是___________(填名称),可以验证该结论的实验是 。
A.将在空气中放置已久的铝条、镁片分别与热水反应
B.将除去氧气物薄膜的铝条、镁片分别和热水作用,并滴入酚酞溶液
C.将除去氧气物薄膜的铝条、镁片分别分别和2mL、1mol·L-1的盐酸反应
D.比较这两种元素的气态氢化物的稳定性
21.(6分)KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:
2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是 (填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.1molCl2,则转移电子的物质的量为 mol。
(3)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以1g质量的物质得到的电子数)是Cl2的 倍。
22.(6分)已知A是非金属单质,A、B、C、D均含有同一种元素,根据下图中所示变化关系,请完成下列问题。
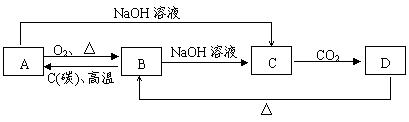 |
(1)写出A、C各物质的化学式:
A 、C 。
(2)写出A→C的离子方程式:
![]() 。
。
| 阅卷人 |
|
| 得 分 |
|
三、实验题(本题包括1道题,共10分)
23.在加热条件下,木炭可被浓H2SO4氧化成CO2。为验证反应产物CO2,选用下图所示装置(含有所盛放的试剂)设计实验。
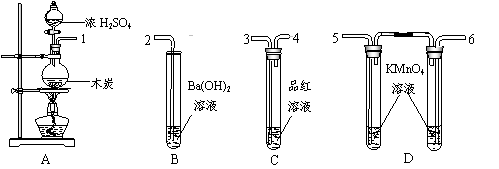 |
(1)写出A中所发生反应的化学方程式____________________________________________。
(2)上图中用于除去干扰气体的装置是 (填字母序号)。
(3)用仪器间相互连接处的数字,表示四种仪器之间的连接顺序:
______接______, _______接_______,_______接________。
(4)根据实验设计填写下表。
| 装置序号 | 实 验 现 象 | 结 论 |
| B | ||
| C |
| 阅卷人 |
|
| 得 分 |
|
四、计算题(本题包括2道题,共10分)
24.(4分)已知某双原子分子构成的气体,其摩尔质量为Mg·mol-1。请完成下列计算(本题均不写计算过程):
(1)该气体在标准状况下的密度为 g·L-1。
(2)该气体一个分子的质量为 g(用含有NA的代数式来表示)
25.(6分)向氢氧化钠溶液中慢慢地通入二氧化硫气体,反应生成正盐,当继续通入过量二氧化硫时,正盐便转化成酸式盐。
(1)写出上述反应的化学方程式
① 。
② 。
(2)标准状态下,向100mL2mol·L-1的NaOH溶液中通入3.36L二氧化硫气体,试求反应后所得溶质的物质的量。
上期期末检测试卷
高一化学参考答案
一、选择题(本题包括18小题,每小题只有一个正确答案,每小题3分,共54分。
⒈ C 2.D 3.B 4.C 5.D 6.A 7.A 8.B 9.A 10.D 11.B 12.A 13.A 14.B 15.D 16.B 17.A 18.B
二、填空题(本题包括4道题,每空2分,共26分)
19. Na2O2 2CO2+2Na2O2=2Na2CO3+O2
20. (1) ② (2)C (3)①Al ② 镁 B、C
21. (1) ② (2)0.2 (3)2.63
22. (1) Si Na2SiO3 (2)Si+2OH-+H2O=SiO32-+2H2↑
三、实验题(本题包括1道题,共10分)
23. (1)C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O (2分)
2SO2↑+CO2↑+2H2O (2分)
(2)D (2分)
(3)1接5,6接3,4接2 (2分)
(4)(4分)
| 装置序号 | 实验现象 | 结论 |
| B | 溶液变浑浊 | 证明产生了CO2 |
| C | 品红溶液不褪色 | 证明SO2已除尽 |
四、计算题(本题包括2道题,共10分)
24.(1)M/22.4 (2分) (2) M / NA(2分)
25.(1)① SO2+2NaOH=Na2SO3+H2O (1分)
② Na2SO3+SO2+H2O=2NaHSO3 (1分)
(2)因反应有可能发生SO2+2NaOH=Na2SO3+H2O ……①
SO2+NaOH=NaHSO3……②
n(NaOH)=0.1L ×2mol·L-1=0.2mol
n(SO2)=3.36L/22.4L·mol-1=0.15mol (1分)
![]()
因1<![]() <2,故反应①、②均发生。 (1分)
<2,故反应①、②均发生。 (1分)
设反应后的溶液中Na2SO3和NaHSO3物质的量分别为x、y
依题意得:
(1分)
![]() 解得:
解得:
(1分)