高一化学上学期月考试卷
一、选择题
1、硅被誉为无机非金属材料的主角。下列物品用到硅单质的是
A、陶瓷餐具 B、石英钟表 C、计算机芯片 D、光导纤维
2、下列物质中常温下既能与NaOH溶液反应,又能与盐酸反应产生氢气是
A、Mg B、Cl2 C、Si D、Al
3、实验室下列物质的保存方法中,不正确的是
A、铝片放在不密封的容器里
B、氢氧化钠溶液盛装在用玻璃塞的试剂瓶中
C、硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D、金属钠保存在石蜡油或煤油中
4、铝在空气中能够稳定存在的原因是
A.铝的活泼性差 B.铝的还原性差
C.铝与氧气不反应 D.铝表面有氧化膜
5.下列物质属于纯净物的是 ( )
A.铝热剂 B.铝土矿 C.铝合金 D.明矾
6、制备硅单质时,主要化学反应如下:
(1)SiO2 +2C ![]() Si +2CO↑ (2) Si + 2Cl2
Si +2CO↑ (2) Si + 2Cl2
![]() SiCl4
SiCl4
(3)SiCl4
+ 2H2 ![]() Si + 4HCl
Si + 4HCl
下列对上述三个反应的叙述中,不正确的是
A、(1)(3)为置换反应 B、(1)(2)(3)均为氧化还原反应
C、(2)为化合反应 D、三个反应的反应物中硅元素均被还原
7.下列各组溶液,只要用试管和胶头滴管,不用任何试剂就可以鉴别的是 ( )
A.KOH和Al2 (SO4)3 B.稀HSO4和NaHCO3
C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4
8、某无色溶液中,放入金属铝,产生了无色气体,则该溶液中下列离子一定能共存的是
A.Na+、Mg2+、HCO3—、NO3— B.K+、Na+、Cl—、SO42—
C.Cu2+、NH4+、SO42—、Cl— D.Na+、Ba2+、Fe2+、NO3—
9、下列离子方程式中书写正确的是
A、铝与盐酸反应 Al + H+ ==Al3++H2↑
B、硫酸铜与Ba(OH)2溶液反应 Cu2++ 2OH-== Cu(OH)2↓
C、铁与FeCl3溶液反应 Fe + Fe3+== 2Fe2+
D、硝酸银溶液与氯化钠溶液反应 Ag+ + Cl-== AgCl↓
10、称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,若放出等气体,则两份铝粉的质量比为
A、1:1 B、2:3 C、1:2 D、1:3
11、除去铜粉中混的有少量氧化铜,其主要操作过程是
A、在空气中燃烧 B、加适量稀硫酸、微热、过滤
C、加适量水、微热、过滤 D、加适量稀硫酸、微热、蒸发
12.某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是 ( )
A、Cl― NO3― Ba2+ Fe3+ B、SO42― S2― Al3+ Mg2+
C、Na+ K+ SO42― Cl― D、 NH4+ Ba2+ Cl― HCO3―
13.在某溶液中酚酞呈粉红色,下列离子在该溶液中不能大量存在的是 ( )
A.K+ B.Na+ C.Ba2+ D.Al3+
14、加入稀HCl后,溶液中下列离子数目减少的是
A.Al3+ B.SO42- C.CO32- D.Mg2+
15、将少量锌投入硫酸铜溶液中,过一会儿,固体质量
A、增加 B、减少 C、不变 D、无法判断
16、镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有
A.![]() B.Cu2+ C.Al3+ D.Mg2+
B.Cu2+ C.Al3+ D.Mg2+
17.下列各金属的混合物2.5g和足量的盐酸反应,放出的H2在标准状况下体积为2.24L,其中可能的是 ( )
A.Zn和Fe B.Mg和Zn C.Al和Mg D.Cu和Fe
18.(06高考江苏)将5.4g Al 投入到200.0mL 2.0mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为( )
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
19.用铝热法还原下列氧化物,制得金属各1mol,消耗铝最少的是 ( )
A.MnO2 B.WO3 C.Cr2O3 D.Co3O4
工业上制取金刚砂的化学反应方程式如下:SiO2 + 3C ![]() SiC + 2CO2
SiC + 2CO2
A.1:2 B.2:1 C.5:3 D.3:5
20、下列有关物质用途的叙述不正确的是
A、用氧化亚铜作制造红色玻璃的颜料 B、氢氧化钠可作色素的吸附剂
C、用铝制餐具长时间存放碱性食物 D、明矾可用作净水剂
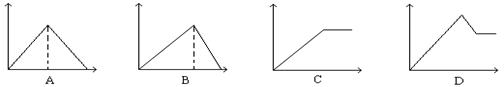
21、向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
22.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
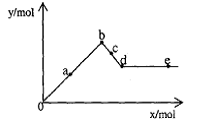 A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:Ba2+可能等于OH-
23、合理利用化学反应可以造福人类。请写出下列反应的化学方程式、
(1)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2 。
(2)工业上漂白粉的漂白原理
24、写出下列反应的离子方程式。
(1)FeCl3溶液中加入NaOH溶液
(2)Al粉加入足量的稀盐酸中
(3)铁棒投入硫酸铜溶液中
(4)少量CO2通入澄清石灰水中
25、(6分)明矾是一种 盐。其在水中的电离方程式是 ,明矾的用途 。
二、填空题
26.将一个用金属铝做的易拉罐内充满CO2,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪的罐又重新鼓起来。
(1)罐壁内凹而瘪的原因是 ,
反应的化学方程式为 。
(2)罐重新鼓起来的原因是 。
反应的化学方程式为 。
27.在右边图式中,E是不溶于水的白色胶状物质,试推断:
(1)A、B、C、D、E的化学式:
A 、B
C 、D
、E
。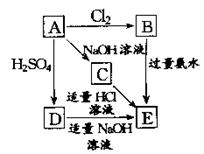
(2)写出下列反应的离子方程式:
①D→E: ;
②B→E: 。
28.① Na、Mg、Al分别与足量的盐酸反应,相同条件下产生等体积的H2,则Na、Mg、Al的物质的量之比为 ② 等质量的Na、Mg、Al分别跟足量的盐酸反应,产生H2的质量比为 ③ Na、Mg、Al分别与足量的硫酸反应,产生等质三、计算
29.由铝和某种金属组成的混合物,将它分成质量相等的两份。一份放入过量的盐酸中,混合物全部作用完,放出H2 6.16 L(标准状况),溶液质量比反应前增加4.85 g;另一份放入过量烧碱溶液中,反应完毕后,放出H2 4.48 L(标准状况),溶液的质量比反应前增加3.2 g,而某金属则不反应,沉积出来。
求:⑴原混合物中某金属的质量。
⑵某金属的相对原子质量。
二、填空题
8.拉曼光谱证实,溶液中不存在AlO2-,却存在Al(OH)4-离子,写出AlCl3与过量NaOH溶液作用的化学方程式 ,Al与烧碱溶液反应的离子方程式
10.(05年4月广州三测)下图表示的是用明矾 [KAl(SO4)2·12H2O] 制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。
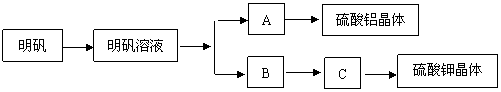 ③
③
① ②
④ ⑤
(1)进行操作②时,加入的试剂 ,其反应的离子方程式为 ,从反应混合物中分离A所使用的实验装置是 。
(2)进行操作④时,所加入的试剂是 ,其目的是
, 同时要对反应混合物进行的操作是 。
三、计算题
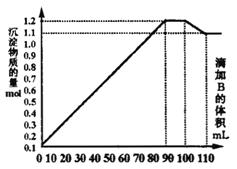 9.向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如右图所示:
9.向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如右图所示:
(1)当加入B溶液110 mL时,溶液中的沉淀是__________________(填化学式)。
(2)溶液B中Na2SO4与NaOH的物质的量浓度之比____________;从90 mL至100 mL之间加入10 mL B溶液时所发生的离子反应方程式是__________。
(3)将A、B溶液中各溶质的物质的量浓度填入下表:
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| 浓 度
|
14、生成H2的物质的量为
16.8L /22.4 L/mol =0.075 mol
(1)设含Fe的物质的量为x,Fe2O3的物质的量为y
Fe + H2SO4=FeSO4+H2↑
1mol 1mol 1mol
0.075mol 0.075mol 0.075mol
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
1mol 3mol 1mol
y 3y y
Fe + Fe2(SO4)3=3FeSO4
1mol 1mol 3mol
y y 3y
x=y+0.0075mol
苏教版必修1专题3 第一单元课时练习2 铝的氢氧化物(B卷)
一、选择题
1.D 2.C 3.A 4.C 5.C 6.A 7.B
二、填空题
8.答案:AlCl3+4NaOH==NaAl(OH)4+3NaCl;2Al+2OH-+6H2O==2Al(OH)4-+3H2↑
10.(1)过量的氨水,Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 过滤器
(2)KOH 将溶液中的NH4+ 转化为 NH3·H2O 加热、搅拌
三、计算题
9.(1) BaSO4 Fe(OH)3 (2) Ba2+ + SO42- = BaSO4 Al(OH)3 + OH- = AlO2- + 2H2O
(3) 10 10 10 2 1
苏教版必修1专题3 第一单元课时练习2 铝的氢氧化物
一、选择题
1.D 2.C 3.D 4.D 5.A 6.C 7.B
二、填空题
8.⑴CO2与NaOH溶液反应使罐内气体的压强减少:
CO2+2NaOH==Na2CO3+H2O。
⑵Al与NaOH溶液反应使罐内气体的压强增大:
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
9. A:Al B:AlCl3 C:NaAlO2 D:Al2(SO4)3 E:Al(OH)3
10.①6:3:2 ②![]() ③23:12:9
③23:12:9
三、计算
11.【解析】⑴某金属与盐酸产生的H2为:
![]() =0.075mol.
=0.075mol.
该金属与盐酸反应使溶液增重为:
4.85g-3.2g=1.65g.
m(金属)=1.65g+0.075mol×2g·mol-1=1.8g,
原混合物中该金属为3.6g
⑵设该金属化合价为+n
则M(金属)=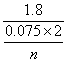 =12n
=12n
![]() 讨论n= 1 M=12(舍)
讨论n= 1 M=12(舍)
2 M=24
3 M=36(舍)
【答案】⑴3.6g ⑵24