高一化学下学期第一次考试试卷(理科)
命题人:李新朵
可能用到的相对原子质量:Ca:40 S:32 Mg:24 Al:27 O:16 Na:23 K:39 H:1
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
1.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是(
)
的形式存在。下列说法正确的是(
)
A.![]() 原子核内含有4个质子 B.
原子核内含有4个质子 B.![]() 和
和![]() 互为同位素
互为同位素
C.![]() 原子核内含有3个中子
原子核内含有3个中子
D.![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
2.A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
3.下列关于过氧化氢的说法正确的是( )
A. 过氧化氢具有杀菌消毒作用,是强酸 B. 过氧化氢是离子化合物
C. 过氧化氢可以发生分解反应 D.过氧化氢是水的同素异形体
4.下列说法错误的是( )
A.原子及其离子的核外电子层数等于该元素所在周期序数
B.主族元素的最高正化合价等于它所处的族序数。
C.元素性质呈周期性变化是元素的原子核外电子排布呈周期性变化的必然结果
D.同一元素的各种同位素的化学性质基本相同
5.国际无机化学命名委员会在1989年作出决定,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,碱金属族为第1列,稀有气体为第18列。按这个规定,下列说法不正确的是( )
A.第15列元素的最高价氧化物为R2O5 B.第2列元素中肯定没有非金属元素
C.第17列元素的第一种元素无含氧酸 D.第16、17列元素都是非金属元素
6.下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O B.BF3 C.CCl4 D.PCl5
7.Xn+和Ym—与氖原子的电子层结构相同。下列叙述正确的是( )
A.微粒半径Xn+ 大于Ym— B.X原子的质子数比Y的大
C.X的原子半径比Y的小 D.X元素的原子序数比Y的小
8.下列物质的晶体中,既含有离子键,又含有非极性共价键的是 ( )
A.NaOH B.Na2O2 C.CaCl2 D.H2O2
9.设某元素原子核内的质子数为m,中子数为n,则下列结论正确的是( )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子的质量为W克,则此原子的质量为(m+n)W克
D.核内中子的总质量小于质子的总质量
| X | ||
| Y | ||
| Z |
10.短周期元素X、Y、Z在元素周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1 mol X的单质跟足量水反应时,发生转移的电子为2 mol
D.Z2-的还原性大于Y-的还原性
11.同周期的三种元素X、Y、Z,已知它们的最高价氧化物对应的水化物的碱性由强到弱的顺序为 XOH > Y(OH)2 > Z(OH)3 ,则下列叙述中正确的是( )
A.原子的失电子能力 X > Y > Z
B.X、Y、Z的单质与水反应是越来越容易
C.原子半径 Z > Y > X D.原子序数X > Y > Z
12.X元素的阳离子和Y元素的阴离子具有相同的核外电子结构,下列叙述正确的是( )
A.原子序数X<Y B.原子半径X<Y
C.离子半径X>Y D.原子最外层电子数X<Y
13.碲(Te)为第五周期,第ⅥA族元素,它的化合物是一种常用的DVD光盘记录材料。下列有关该元素的叙述中,正确的是( )
A.气态氢化物稳定性H2S﹤H2Te B.非金属性:S﹥Te
C.Te的最高正化合价为+4价 D.酸性:H2SO4﹤H2TeO4
14.某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
15.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
 高一化学下学期第一次考试试卷(理科)
高一化学下学期第一次考试试卷(理科)
命题人:李新朵
一、选择题答题表(本题共15小题,每题3分,共15×3=45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题(本题共5小题,共43分)
16.(8分)在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系,约占人体总重(质量)99.97%的11种宏量元素全部位于元素周期表前20号元素之内,其余0.03%是由10多种人体不可缺少的微量元素组成。在微量元素中,只有F和Si位于短周期,其余的均属于第一长周期。在现用的元素周期表中,针对除H、N、P外的宏量元素填空(填元素符号)
(1)原子最外层电子数是最内层电子数2倍的是 。
(2)最高正化合价的数值比其它元素高的元素是 ,跟它处在同一周期的、单质显非金属性的元素是 。
(3)原子半径最大的元素是 ,在周期表中,它的相邻元素是 和 。
(4)剩余的两种宏量元素,它们的离子具有相同的电子层结构,且带电量也相同,但符号相反,它们是 和 。
17.(13分)有X、Y、Z三种元素,它们的原子序数依次增大,且位于同一周期,价电子数之和为10.它们的最高价氧化物的水化物之间,任意两种都能反应生成盐和水.M元素位于上述三种元素相邻的周期,而M元素原子的L电子层上有4个电子.试写出:
(1)X、Y、Z、M的元素符号:X________、Y________、Z________、M________.
(2)Y位于元素周期表中 周期,第 族。
(3)Z原子的原子结构示意图 。
(4)X、Y、Z的最高价氧化物的水化物之间两两反应的离子方程式分别为(不按顺序) 、
、 。
18.(8分)有A、B、C、D四种短周期元素,A、B、C为同一周期的依次相邻的三种元素,A和C的原子序数之比为3:4,A、B、C都可以与D形成电子总数相等的化合物。
(1)A、B、C与D形成的电子总数相等的化合物的电子式分别为:
___________________、___________________、____________________。
(2)A与C两元素形成的化合物中有一种为AC2,用电子式表示出AC2的形成过程:
。
19.(6分)A、B、C、D、E五种元素,它们的原子序数依次增大,A原子最外层有4个电子。B的阴离子与C的阳离子跟氟离子的电子层结构相同。E原子的M层上的电子数比次外层少1个电子。常温、常压下B单质是气体,0.1mol单质B与氢气完全反应时,有2.408×1023个电子发生转移。C的单质在高温下与B的单质充分反应之后,生成淡黄色固体F,F与AB2反应后可生成单质B。D的氢化物化学式是H2D,D的最高氧化物中含有40%的D,而且D原子是由相同数目的质子、中子、电子组成,根据以上的已知条件进行推测:
(1)下列元素的名称:D ,E 。
(2)写出下列反应的化学方程式:
F与AB2反应: 。
20.(8分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A的单质和它的一种氧化物是工业生产上常用的还原剂。B的最外层电子数是次外层的3倍;0.1molC的单质能从酸溶液中置换出2.24L标准状况下的氢气;又知B、C、D所形成的简单离子的电子层结构相同,B和E是同主族的元素。请回答下列问题:
(1)请依次写出A、C、E三种元素的元素符号:______、______、_______。
(2)E的单质在空气中燃烧所生成物质的化学式_________
(3)请写出A的最高价氧化物的电子式_____________;
(4)请写出D的最高价氧化物与氢氧化钠溶液反应的离子方程式____________________________________
三、计算题(本题共2小题,共12分)
21.(6分)0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,0.4gX的单质与足量盐酸反应放出0.02g氢气;X中中子数和质子数相等;Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸。
(1)推断X、Y两元素的元素符号:X________、Y________.
(2)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应:__________________________________
22.(6分)同一周期依次相邻的A、B、C三种元素,都是短周期元素。A的最高价氧化物的化学式是A2O。11.6gB的氢氧化物恰好能与200mL2mol/L盐酸完全反应,B原子核中质子数与中子数相等。回答以下问题:
(1)B的元素符号为 。
(2)A、B、C的最高价氧化物的水化物的化学式分别为________、_______、________.
(3)A、B、C的单质各1mol分别与足量的稀H2SO4反应,产生H2最多的单质是___ (填元素符号),该单质产生H2的体积在标准状况下是 L.
 高一化学下学期第一次考试试卷(理科)
高一化学下学期第一次考试试卷(理科)
一、选择题答题表(15×3=45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | C | A | D | C | B | B | A | D |
| 题号 | 11 | 12 | 13 | 14 | 15 |
| ||||
| 答案 | A | D | B | C | B |
| ||||
16(8分)(1)C (2)Cl ;S
(3)K ;Na、Ca (4)Mg;O
17、(13分)(1)Na Al S C 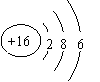 (2) 第三周期第三主族
(2) 第三周期第三主族
(3)
(4) H++OH-=H2O
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O
19 (6分)(1)硫;氯; (2)2Na2O2 + 2CO2 == 2Na2CO3 + O2
20.(1)C Mg S (2) SO2
(3):![]() :C::
:C::![]() :
:
(4)![]()
21(6分)(1)X:钙 Y:氯
(2)2Ca(OH)2 + 2Cl2 ==CaCl2+ Ca(ClO)2+ 2H2O。
22. (6分)(1)Mg
(2)NaOH Mg(OH)2 Al(OH)3
(3)Al 33.6