高一化学第二次月考试题
命题人:李新朵
相对原子质量 H-1 C-12 N-14 O-16 Na-23 K-39 S-32
Al-27 Mg-24 Ca-40 Fe-56 Cl-35.5 Zn-65 He-4
第Ⅰ卷
一、选择题(下列各题只有一个正确答案,每小题3分,共45分)
1.漂白粉的有效成分是 ( )
A.Ca(OH)2 B.Ca(ClO)2 C.CaCl2 D.CaCO3
2.下列物质久置于空气中,不会变质的是 ( )
A.Na2O2 B.Na2CO3 C.NaOH D.氯水
3.容量瓶是准确配制一定物质的量浓度溶液的仪器,其瓶壁上没有标记 ( )
A.温度 B.容量 C.浓度 D.刻度线
4.在下列物质中,其物质的量为1mol的是 ( )
A.32g氧气 B.22g二氧化碳 C.49g硫酸 D.36g水
5.在标准状况下,相同质量的下列气体中体积最大的是 ( )
A.O2 B.Cl2 C.N2 D.CO2
6.下列说法不正确的是 ( )
A.在标准状况下, 1molCO2的体积约为22.4L
B.在标准状况下, 1molH2SO4的体积约为22.4L
C.在标准状况下, 1mol的H2与O2的混合气体体积约为22.4L
D 在常温常压下, 1 mol各种气体的体积约相同
7.NA代表阿伏加德罗常数,下列说法正确的是( )
A.2.4g金属Mg变成镁离子时失去的电子数为0.1NAV
B.17g氨气所含分子数目为NA
C.在常温常压下,11.2L氮气所含的原子数为NA
D.2g氢气所含原子数目为NA
8.在某温度和压强下,30mLNO气体发生分解反应生成10mLNO2气体和10mLX气体,则X气体的分子式是( )
A .O2 B. N2 C.N2O D.N2O3
9.向0.1mol / L NaOH溶液中通入过量CO2后,溶液中存在的主要离子是 ( )
A.Na+、CO32- B.Na+、HCO3- C.HCO3-、CO32- D.Na+、OH-
10.3L 0.1mol/LFeCl3溶液与2L 0.6mol/L的KCl溶液中,所含Cl-的物质的量浓度之比为 ( )
A.1:2 B.1:1 C.1:3 D.3:2
11.将30mL 0.5mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为 ( )
A.0.03mol/L B.0.3mol/L C.0.05mol/L D.0.04mol/L
12.0.5mol某气体的质量为32g, 则该气体是 ( )
A.CH4 B.O2 C.HCl D.SO2
13.CO和CO2的混合气体对氢气的相对密度为18,则CO、CO2的物质的量之比为 ( )
A.1:2 B.1:1 C.2:1 D.任意比
14.钫(Fr)是核电荷数最大的碱金属元素,关于它的单质及化合物性质的推测
不正确的是 ( )
A.单质的熔点比钠低 B.单质与水反应比钠剧烈
C.可呈现焰色反应 D.碳酸正盐易分解
15.在273K和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是 ( )
A.6.72 L B.7.84 L C.10.08 L D.13.44 L
二、选择题(下列各题有1至2个正确答案,每小题3分,共15分)
![]() 16.下列离子方程式错误的是 ( )
16.下列离子方程式错误的是 ( )
A.氢氧化铝与盐酸反应:
B.NaHCO3溶液与醋酸反应: HCO3- +H+ = H2O + CO2↑
C.Cl2通入水中: Cl2+H2O=2H++Cl-+ClO-
D.NaOH溶液与小苏打溶液反应: HCO3- + OH- = H2O + CO32-
17.两个体积相同的甲、乙两容器中,一个充满C2H4气体,另一个充满C2H2和C2H6的混合气体,则同温同压下,两个容器内的气体一定相同的是 ( )
A.分子总数 B.原子总数 C.碳原子数 D.氢原子数
18.依照阿伏加德罗常数定律,下列叙述正确的是 ( )
A.同温同压下,两种气体的体积之比等于摩尔质量之比
B.同温同压下,两种气体的物质的量之比等于密度之比
C.同温同压下,两种气体的摩尔质量之比等于密度之比
D.同温同容下,两种气体的物质的量之比等于压强之比
19.已知KH和H2O反应生成H2和KOH,反应中1mol KH ( )
A.失去1mol电子 B.得到1mol电子
C.失去2mol电子 D.没有电子得失
20.由锌、铁、铝、镁四种金属中的两种组成的混合物10.0g,与过量盐酸反应,产生的氢气在标准状况下的体积为11.2L,则混合物中一定含有的金属是 ( )
A. 锌 B.铁 C.铝 D.镁
高一化学试题答题卷
第Ⅰ卷答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷
三、填空题(14分)
21.(6分)写出实验室制取Cl2的化学方程式和离子方程式,在化学方程式中标明电子转移的方向和数目。
22.(8分)在标准状况下224L NH3。 其质量是 g,含氢原子数为 NA。
将其全部溶解于730mL水中,形成密度为0.9g/cm3的溶液,其物质的量浓度
为 mol/L ,溶质的质量分数为
四、实验题(14分)
23.(7分)实验室用密度为1.19g/cm3, 37.5%的浓盐酸配制1000mL 0.5mol/L的盐酸,
回答下列问题:
(1)需要的仪器有 mL容量瓶及烧杯、玻璃棒以外,还有 、 。
(2)使用容量瓶前,应进行的操作是 。
(3)下列情况会使结果偏低的是 ( )
A.容量瓶未干燥 B.转移溶液之后未洗涤烧杯和玻璃棒
C.定容时俯视刻度线观察液面 D.容量瓶盛过该溶液但未洗净
(4)本实验完毕,从容量瓶中倒出溶液后,要洗涤容量瓶。若每次倒出溶液后残留在瓶壁的溶液为1mL,每次都加水至刻度线,则洗涤2次后残留在瓶壁的溶液的物质的量浓度为 mol/L(用A×10-a形式表示)
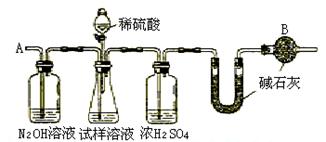
24.(7分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
|
主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测定的结果 (填偏高、偏低、不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
五、计算题(12分)
25.(4分)4.8g金属镁加入到200mL硫酸溶液中,恰好完全反应。
求①生成的气体在标准状况下的体积。
②硫酸的物质的量浓度。
26.(8分)有含等物质的量的Na2CO3和K2CO3混合物24.40g的溶液与100mL盐酸混合。
⑴混合物中Na2CO3的物质的量为 。
⑵欲求标准状况下生成CO2的体积,还缺少的一个数据是 。
⑶若盐酸不足量时,并将混合物的盐溶液逐渐滴入盐酸时,所缺数据的取值范围是 。
⑷若Na2CO3和K2CO3不是等物质的量混合,则24.4g固体与足量的盐酸完全反应时,在标准状况下生成CO2体积(V)的取值范围是 。
高一化学试题答案
第Ⅰ卷答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | 3 | A | C | B | B | C | B | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | D | A | D | D | BC | AC | CD | A | C |
第Ⅱ卷
三、填空题(14分)
21.(6分)
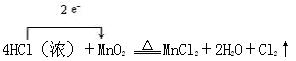
4H+ + 2Cl-(浓)+MnO2
![]() Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
22.(8分) 170 , 30 , 1 , 18.9%
四、实验题(14分)
23.(7分)
(1) 1000 , 量筒 、 胶头滴管 。
(2) 检查是否漏水 。
(3) B ,
(4) 5.0 ×10-7 。
24.(7分)
(1)样品重,砝码轻
(2)防止空气中的CO2和水气进入U型管中
(3)偏高
(4)把反应产生的CO2全部导入U型管中
(5)判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收
(6)![]()
(7)答案略。
五、计算题(12分)
25.(4分)解:设气体在标准状况下的体积和硫酸的物质的量浓度各为 x和Y
Mg + H2SO4 = MgSO4 + H2↑
24g 1mol 22.4L
4.8g 0.2L×X Y
X = 1.0mol.L-1 , Y = 4.48L
答:略。
26.(8分) 0.1mol
⑵ 盐酸的物质的量浓度
⑶ C(HCl) < 4mol.L-1
⑷ 3.96L < V < 5.16L