高一化学第二学期期中考试
化学试卷
总分120分 时间100分钟
可能用到的原子量:H:1 Mg:24 Ca:40 Cl:35.5
一、选择题(每小题3分,共30分。每小题只有一个选项符合题意)
1、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A、利用电池外壳的金属材料
B、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C、不使电池中渗泄的电解液腐蚀其他物品
D、回收其中石墨电极
2、提出元素周期律并绘制了第一个元素周期表的科学家是
A、.戴维 B、阿伏加德罗 C、门捷列夫 D、道尔顿
3、下列化合物中既有离子键又有共价键的是
A、NaBr B、KOH C、HCl D、NH3
4、下列能源是通过化学反应产生的是:
A、太阳能 B、潮汐能 C、风能 D、氢气燃烧生成的热能
5、下列粒子中,其最外层与最里层的电子数之和等于次外层电子数的是
A、 S B、Mg C、 Cl D、 Be
6、 下列属于同位素的一组是
A、O2、O3 B、Na2O、Na2O2
C、![]() 、
、![]() D、H、D、T
D、H、D、T
7、可逆反应达到平衡的重要特征是:
A、反应停止了 B、正、逆反应的速率均为零
C、正、逆反应都还在继续进行 D、正、逆反应的速率相等
8、某元素二价阳离子的核外有18个电子,质量数为40,该元素的原子核中的中子数为
A、16 B、18 C、20 D、22
9、决定化学反应速率的主要因素是
A、参加反应的物质本身的性质 B、催化剂
C、温度、压强以及反应物的接触面 D、反应物的浓度
10、下列说法中,错误的是:
A、任何化学反应都伴随能量的变化
B、化学反应中的能量变化都表现为热量变化
C、反应物的总能量高于生成物的总能量时,发生放热反应
D、反应物的总能量低于生成物的总能量时,发生吸热反应
二、选择题(每小题3分,共36分。每小题可能有一个到两个选项符合题意)
11、下列微粒中,与OH― 具有相同的质子数和相同的电子数的是
A、F- B、NH4+ C、NH3 D、Ne
12、下列关于化学反应速率说法正确的是
A、Al在氧气中燃烧生成Al2O3,将Al片改成Al粉可加快反应速率
B、根据化学反应速率的大小可以知道化学反应进行的快慢
C、Fe与稀硫酸反应制H2时,改用浓硫酸可加快反应速率
D、对任何化学反应来说,反应速率越大化学现象越明显
13、关于原子结构的叙述正确的是
A、所有的原子核都是由质子和中子组成的
B、原子的最外层电子数不超过8个
C、稀有气体原子的最外层电子数均为8
D、原子的次外层电子数都是8
14、与Li<Na<K<Rb<Cs的变化规律(由弱到强或由低到高或由少到多)不符合的是
A、与水或酸反应置换氢气的难易 B、金属性的强弱
C、熔点 D、电子层数
15、下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
A、11和16 B、12和17 C、14和8 D、7和8
16、下列叙述中, a金属肯定比b金属活泼性强的是
A、a原子的最外层电子数比B原子的最外层电子数少
B、a原子电子层数比b原子的电子层数多
C、1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D、常温时,a能从水中置换出氢,而b不能
17、下列说法正确的是
A、由H原子形成1 mol H-H键要吸收热量
B、所有燃烧反应都是放热反应
C、原电池是将化学能转化为电能的装置
D、凡经加热而发生的化学反应都是吸热反应
18、下列各组元素性质递变情况错误的是
A、Li、Be、B原子最外层电子数逐渐增多 B、N、O、F原子半径依次增大
C、P、S、Cl最高正价依次升高 D、F-、Cl-、Br-的非金属性依次增强
19、下列反应中,属于吸热反应的是:
A、Mg+2HCl===MgCl2+H2↑
B、Ba(OH)2+2NH4Cl===BaCl2+2NH3↑+10H2O
C、葡萄糖在人体内的氧化
D、盐酸和烧碱的反应
20、下列关于元素周期表的认识中,其中不正确的是
A、P、Ca、Fe、I等元素都是短周期元素
B、元素性质主要是由原子最外层电子数决定的
C、元素原子的电子层数等于其所在周期的周期序数
D、主族元素原子的最外层电子数等于其所在族的族序数
21、13C-NMR(核磁共振)可用于含碳化合物的结构分析14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是
A、13C与15N具有相同的中子数 B、13C与C60是同一种物质
C、15N与14N具有相似的化学性质 D、15N的核外电子数与中子数相同
22、已知合成氨反应的浓度数据如下:
| N2 + 3H2 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | 0.8 |
当用氨气浓度的增加来表示该化学反应速率时,其速率为
A、0.2 mol/(L·s) B、0.4 mol/(L·s) C、0.6 mol/(L·s) D、0.8 mol/(L·s)
三.填空题(每空格2分,共46分)
23、(8分)下列变化A.碘的升华B.烧碱熔化C.氯化钠溶于水D.氯化氢溶于水E.氯化铵受热分解。(1)未发生化学键破坏的是 ;(2)仅发生离子键破坏的是_____________ ;(3)仅发生共价键破坏的是 ;(4)既发生离子键又发生共价键破坏的是 _________________(填英文字母)
24、(共24分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
涉及到填写的物质写元素符号或化学式
(1) 在这些元素中,化学性质最不活泼的是: ,原子结构示意图为_____________________ 。
(2) 最高价含氧酸酸性最强的酸是_____________,碱性最强的化合物的是:_____________
(3) 单质硬度最大的元素是________其氢化物电子式为_____________
(4) 化合物显两性的氢氧化物是_____ ____;写出它的与氢氧化钠反应的离子方程式_____ _________ _________ _________ _________ ____。
(5) 用电子式表示元素④与⑦的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(6)写出①与⑦形成化合物的分子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
25、(14分)根据下图填空(涉及到电极填写具体物质名称或元素符号)
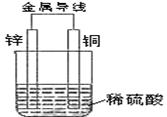 (1)正极:
负极 _
(1)正极:
负极 _
(2)正极发生 反应
负极发生 反应(填写氧化或还原反应)
(3)电子流向从 (填具体电极)
(4)H+向 移动,溶液PH (填变大或变小)
四.计算题(本题8分)
26、某元素的原子为AZX ,9.5g该元素的氯化物XCl2配成溶液后,需用200 mL 1mol/L的AgNO3溶液才能把氯离子沉淀完全,已知,X元素核内质子数和中子数相等。据此请计算出A值,写出该元素符号并确定其在周期性表中的位置。