高一化学第二学期质量检查
化学试题
命题人:陈福天 总分:100分 考试时间:90分钟
可能用到的相对原子质量 H:1 C:12 N:14 O:16 Na:23 Al:27
S:32 Cl :35.5 Ca:40 Fe:56 Cu:64
第I卷(选择题 共45分)
一、选择题(共15小题,每题3分,每小题只有一个正确答案,共计45分。)
1、物质之间发生化学反应时,一定发生变化的是 ( )
A、颜色 B、状态 C、化学键 D、原子核
2、科学家最近发现2种粒子:第1种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是 ( )
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式为O4
3、下列实验操作中,正确的是 ( )
A、配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B、配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
4、下列四种物质中,有一种物质与其它三种物质不属于同一类,该物质是 ( )
A、Na2O B、Na2O2 C、NaOH D、Na
5、两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温、同压下放出气体的体积比为1:2,则两份铝片的质量之比为 ( )
A、1:1 B、2:3 C、3:2 D、1:2
6、由一氧化碳和另一种气体组成的混合气体的含氧质量分数为50%,则另一种气体可能是( )
A、N2O B、CO2 C、NO2 D、NO
7、不能通过化合反应制取的是 ( )
A、FeCl2 B、Fe2(SO4)3 C、Fe(OH)3 D、NaHCO3
8、Cl2气通入品红和AgNO3的混合溶液中,能观察到的现象是:①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀 ( )
A、①② B、①③ C、②③ D、②④
9、X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
A、原子半径:W> Z>Y>X
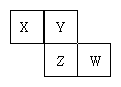 B、最高价氧化物对应水化物的酸性:Z>W>X
B、最高价氧化物对应水化物的酸性:Z>W>X
C、4种元素的单质中,Z单质的熔、沸点最低
D、W单质能与水反应,生成一种具有漂白性的物质
10、能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是 ( )
A、分别加热这两种固体物质,并将生成的气体通入澄清石灰水中
B、分别将两种物质配成相同物质的量浓度的溶液,用PH试纸测溶液的PH
C、分别在这两种固体中,加入同浓度的稀盐酸
D、分别将两种物质进行焰色反应
11、下列除去杂质的方法正确的是 ( )
A、除去KNO3中的少量KCl:结晶、过滤
B、除去Na2CO3中的少量NaHCO3:加热
C、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
D、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
12、下列反应的离子方程式书写正确的是 ( )
A、钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
B、金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2
C、金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D、铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
13、某溶液中有NH4+、Mg2+、Fe2+、和Al3+四种离子,若向装有该溶液的试管中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 ( )
①NH4+ ②Mg2+ ③Fe2+ ④ Al3+
A、①③ B、①②③④ C、②④ D、④
14、NA表示阿伏加德罗常数。下列说法中正确的是 ( )
A、1moLNH4+中含有电子数为11 NA
B、1moLCO2中含有共用电子对数为2 NA
C、标准状况下,22.4升钠的质量约为23g
D、483gNa2SO4·10H2O中所含水分子的数目是15 NA
15、将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu完全溶解时,共收集到气体1.12L(标准状况),下列有关该反应的说法中不正确的是 ( )
A、Cu和浓HNO3反应是氧化还原反应
B、被还原的HNO3为0.05mol
C、转移0.08mol的电子
D、气体仅由NO2组成
第II卷(非选择题 55分)
二、填空题:(计27分)
16 (6分)若实验室用氯水和KSCN溶液检某溶液中有无Fe2+,应在待测试液中先加入 、后加入 。若看到 ,说明含Fe2+。
17(9分)有一瓶溶液只含Cl-、CO32-、SO42-、Na+、NH4+、K+、Mg2+ 七种离子中的某几种。经实验:
(1)
原溶液 ![]() 白色沉淀;
白色沉淀;
(2) 将(1)所得溶液 ![]() 放出使紫色石蕊试液变蓝的气体;
放出使紫色石蕊试液变蓝的气体;
(3) 原溶液中加BaCl2溶液不产生沉淀;
(4)原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
回答下列问题:
(1)试分析原溶液中一定含有的离子是_________________________,一定不含有的离子是______________________, 可能含有的离子是______________________。
(2)有同学认为实验(4)可以省略,你认为呢?(填符号:A-可以,B-不可以)
说明理由 。
18(6分)在新疆与青海两省区交界处有一狭长山谷,每当牧民和牲畜进入后,风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜皆遭雷击而倒毙。奇怪的是这里的牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。
试用化学方程式表示“魔鬼谷”牧草茂盛,四季常青的原因。
(1)______________ _____
(2)___________ ________
(3)________ ___________
19 (6分) 甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种,将它们两两混合后,观察到如图所示的现象,其中丁与乙产生的是无色气体。
| 甲 | 乙 | 丙 | 丁 | |
| 甲 | — | ↓ | ↓ | — |
| 乙 | ↓ | — | ↓ | ↑ |
| 丙 | ↓ | ↓ | — | ↓ |
| 丁 | — | ↑ | ↓ | — |
请回答下列问题:
⑴写出丁与乙反应的离子方程式
⑵这四种溶液中溶质的化学式分别是:甲 ,乙 ,丙 ,丁 。
三、实验题:(计21分)
20(7分)(本题共2小题)
⑴ 配制500mL 2.5mol/L浓度的NaOH溶液时,需要的玻璃仪器,除了烧杯、玻璃棒外,还必须有的是 、 。
⑵ 现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 | 熔点/oC | 沸点/oC | 密度/g·cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| 物质 | 熔点/℃ | 沸点/℃ | 度/g·cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是: 。
21(14分)海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
![]()
(1)写出提取碘的过程中有关的实验操作名称:① ③ ;
(2)写出过程②中的有关反应的化学方程式 。
(3)在过程②反应中的氧化剂的电子式是____ ___, 若生成1mol的单质生成物共转移了 mol的电子。NaCl固体是 晶体。
(4)提取碘的过程中,可供选择的有机试剂有
A.四氯化碳 B.酒精 C.醋酸
四、计算题:(计7分)
22(7分)往100 mL 1mol/L的AlCl3溶液中滴加1mol/L的NaOH溶液,得到5.85g沉淀,则加入NaOH溶液的体积可能是多少毫升?
高一化学答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | C | A | D | D | A | B | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 | D | D | C | C | A | D | D |
16、(6分)KSCN(2分);氯水(2分);加入KSCN无现象,加入氯水显红色(2分)
17、(9分)
(1)Mg2+、NH4+、Cl-(2分);CO32-、SO42-(2分);Na+ 、 K+、(2分)
(2)A (1分)
溶液显电中性有阳离子存在必有阴离子存在(其他答案合理给分)(2分)
![]() 18、(6分)
18、(6分)
(1)
(2)2NO+O2=2NO2
(3)3NO2+H2O=2HNO3+NO (每个方程式2分)
19、(6分)
(1)CO32-+2H+=CO2↑+H2O (2分)
(2)甲 CaCl2 ,乙 Na2CO3 ,丙 AgNO3 ,丁 HCl (各1分)。
20、(7分)
⑴500mL容量瓶(2分)、胶头滴管(2分);
⑵蒸馏(3分)
21、(14分)
(1) ①过滤 ③萃取; (每空2分,共4分)
(2)Cl2 + 2KI == 2KCl + I2 ; (2分)
(3)电子式略、2、离子 ; (每空2分,共6分)
(2) A (2分)
22、(7分)
(1)225mL (3分)
(2) 325mL (3分)(两个答案同时解出加1分)