高一化学提高测试2
一、选择题
1.按元素核电荷数递增顺序,卤素的有关性质发生递减变化的是( )
(A) 单质的熔点、沸点
(B) 单质的氧化能力
(C) 阴离子的还原能力
(D) 氢化物的稳定性
2.砹是核电荷数最大的卤素,则砹或砹的化合物不可能具有的性质是( )
(A) HAt很稳定
(B) 砹单质容易溶于某些有机溶剂
(C) AgAt不溶于水
(D) 通常状况下,砹单质是有色固体
3.已知2FeCl2+Cl2=2FeCl3,2FeCl3+3KI=2FeCl2+I2+2KCl,某溶液中含有等浓度的氯离子和碘离子,若只氧化碘离子,可以加入的试剂是( )
(A) 氯水
(B) 高锰酸钾溶液
(C) 氯化铁溶液
(D) 氯化亚铁溶液
4.除去氯化钾溶液中少量的硫酸钾,加入试剂和顺序都正确的是( )
(A) 过量的硝酸钡——过量的碳酸钾——盐酸
(B) 氯化钡——碳酸钾——硫酸
(C) 过量的氯化钡——过量的碳酸钾——盐酸
(D) 过量的硝酸钡——碳酸钠——盐酸
5.某溶液中氯离子与溴离子及碘离子个数之比为1:2:3,若要使它们的个数比变为
3:2:1,需要通入氯分子的数目是原溶液中碘离子数目的( )
(A) 1.5倍
(B) 0.33倍
(C) 3倍
(E) 1倍
6.将8.7 g二氧化锰与含HCl 14.6 g的浓盐酸共热来制取氯气,可以制得氯气的质量是( )
(A) 等于7.1 g
(B) 大于7.1 g,小于14.2 g
(C) 小于7.1 g
(D) 大于14.2 g
7.用作麻醉剂的氯仿,常因保存不当而被空气氧化,产生剧毒的光气:2CHCl3+O2=2HCl+2COCl2(光气),为了防止事故的发生,使用前可以用于检验氯仿是否变质的试剂是( )
(A) 淀粉碘化钾试纸
(B) 氢氧化钠溶液
(C) 酚酞试液
(D) 酸性硝酸银溶液
8.用于“点豆腐”的氯化镁结晶水合物的化学式是MgCl2·nH2O.取1 g此晶体溶于水,加入足量的硝酸银溶液,得到1.41 g氯化银。则n值是( )
(A) 2
(B) 4
(C) 6
(D) 8
9. 将氟气通入稀氢氧化钠溶液后,生成氟化钠、水的同时,放出一种无色气体X,X由两种元素组成,其中氟元素的质量分数为70.4%,下列有关说法正确的是( )
(A) 气体X是HF
(B) 气体X的化学式为OF2
(C) 此反应中F2既是氧化剂,又是还原剂
(D) 此反应中F2是氧化剂
10. 溴化碘(IBr)的化学性质很象卤素单质,它可以与大多数金属、非金属化合,生成卤化物,它也可以与水发生如下的反应:IBr+2H2O=HBr+HIO。下列有关溴化碘的叙述中,不正确的是( )
(A) 在很多反应中,溴化碘是很强的氧化剂
(B) 溴化碘与水反应时,碘和溴元素既是氧化剂又是还原剂
(C) 溴化碘是共价化合物
(D) 溴化碘与氢氧化钠溶液反应时,生成溴化钠和次碘酸钠(NaIO)
11. 海带中含有碘元素,有人设计如下步骤来提取碘:(1)通入足量氯气(2)将海带烧成灰,向灰中加水搅拌(3)加四氯化碳振荡(4)过滤(5)用分液漏斗分液。合理的操作顺序是( )
(A)(2)—(4)—(1)—(3)—(5)
(B)(2)—(1)—(3)—(4)—(5)
(C)(1)—(3)—(5)—(2)—(4)
(D)(3)—(1)—(2)—(5)—(4)
12. 为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘。其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3-可以和I-发生反应:IO3-+5I-+6H+=3I2+3H2O,根据此反应,可以用试纸和一些生活中常见的物质检验食盐中是否存在IO3-。可供选用的物质有:(1)自来水(2)蓝色的石蕊试纸(3)淀粉碘化钾试纸(4)淀粉(5)食盐(6)食醋(7)白酒。进行上述实验时,必须使用的物质是( )
(A)(1),(3)
(B)(3),(6)
(C)(2),(4),(6)
(D)(1),(2),(4),(5),(7)
13. 常温下,干燥的淀粉和干燥的锌粒混合不发生反应,如果滴上一滴水,反应立即开始,反应时,出现火光并有紫色蒸气冉冉升起。反应后得到白色粉末碘化锌。试回答:水的作用是( )
(A) 反应物
(B) 氧化剂
(C) 还原剂
(D) 催化剂
14. 下列物质在空气中久置变质,在变质的过程中,既有氧化还原反应,又有非氧化还原反应发生的是( )
(A) 苛性钠溶液
(B) 漂白粉
(C) 氯水
(D) 生石灰
15. 对于3Cl2+6KOH=5KCl+KClO3+3H2O这一反应,下列说法正确的是( )
(A) 被氧化的氯原子是被还原的氯原子的5倍
(B) 氯酸钾是氧化产物,氯化钾是还原产物
(C) 反应中转移的电子数是氯分子数的1.67倍
(D) 氢氧化钾是还原剂
二、填空题
1. 实验室里用二氧化锰跟浓盐酸反应,制取氯气的化学方程式是( )。另外,高锰酸钾是常用的氧化剂。在酸性条件下,MnO4-被还原成Mn2+。用高锰酸钾跟浓盐酸在室温下制取氯气 的反应的化学方程式是( )。最后,历史上曾经用“地康法”制氯气。这一方法是用氯化铜作催化剂,在450 0C时,利用空气中的氧气跟氯化氢反应制氯气。这一反应的化学方程式是( )。以上三种方法的共同点是(
)(请从氯元素化合价的变化上分析)。另外,比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序为( )。
2.从海水中提取溴(海水中的溴以溴化钠存在)的方法之一是:通入氯气把溴化物氧化,然后用空气把生成的溴吹出,用碳酸钠溶液吸收溴生成溴化钠、溴酸钠和二氧化碳,再加硫酸使溴析出。这样得到的溴中可能含有少量的氯,这些氯可以加溴化铁除去。写出上述反应的化学方程式:(1)( )(2)(
)(3)( )(4)( )。
3.1986年,化学史上第一次用非电解法制得氟气,试配平该反应的化学方程式,指出反应中( )元素被氧化,( )是氧化剂。
( )K2MnF6+( )SbF5=( )KSbF6+( )MnF3+( )F2
4.将氯气通入石灰乳中可以得到漂白粉,该漂白粉的主要成分是
Ca(OH)2-3CaCl(ClO)-nH2O。现有一种漂白粉的“有效氯”(过量HCl
和漂白粉作用生成Cl2的量和漂白粉质量之比)为35%。若该漂白粉的组成和上述化学式相符,则式中n的值是( )。
5.向橙黄色的溴水中撒入过量镁粉,充分振荡后过滤,滤液呈( )
色,反应的化学方程式为( );若将滤液分盛在两个试管中,一个试管中加入氯水后振荡并用汽油萃取,汽油油层呈( )色,化学方程式为( )。另一只试管中加入氢氧化钠溶液,现象是( ),化学方程式为( )。
6.有些物质如氰(CN)2、硫氰(SCN)2与卤素分子性质相似。请写出下列化学方程式:
(1)(SCN)2与NaOH溶液反应( )。
(2)HCN与MnO2反应( )。
三、实验题
7.G、Q、X、Y、Z,均为氯的含氧化合物,它们在一定条件下,具有如下的转换关系(均未配平):
G---Q+NaCl
Q+H2O---X+H2(此反应需要在电解条件下进行)
Y+NaOH---G+Q+H2O
Z+NaOH---Q+X+H2O
由此判断,这五种化合物中氯的化合价由高到低的顺序为( )。
若五种化合物中有一种为NaClO4,则NaClO4应是( )。
四、计算题
8.将11.70 g氯化钠与15.00 g质量分数为98%的硫酸混合,微热,使反应完全。再将所得气体全部通入45.00 g的水中完全吸收后,求得到的盐酸中溶质的质量分数是多少?
9.为了测定某溶液中HCl和NaCl的含量,进行如下实验,称取10 g该溶液,用8 g 10%的NaOH溶液恰好中和,然后向此中性溶液中加入足量的AgNO3溶液,生成5.74 g AgCl沉淀,求原溶液中HCl和NaCl的质量分数。
10.自来水用氯气消毒沿用已久,现正在研究采用二氧化氯(ClO2)消毒自来水。它消毒后的还原产物是Cl-。据文献报道,ClO2消毒的效率是Cl2的2.63倍左右,通过计算说明其倍数关系。
参考答案
一、选择题
1.B,D 2.A 3.A,C 4.C 5.B 6.C 7.D 8.C 9.B D
10.B 11.A 12.B 13.D 14.B C 15. B,C
二、填空题
![]() 1.
1.
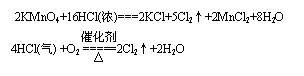 |
-1价的氯被氧化成0价的氯,KMnO4> MnO2> O2.
2.Cl2+2NaBr=2NaCl+Br2
3Br2+Na2CO3=NaBr+NaBrO3+CO2↑
5NaBr+ NaBrO3+3H2SO4=3H2O+3Br2+ 3Na2SO4
2FeBr3+3Cl2==2FeCl3+3Br2
3.![]() ,K2MnF6, 2,4,4,2,1
,K2MnF6, 2,4,4,2,1
4.8,5.
5. 无色,Mg+Br2=MgBr2,
橙红,MgBr2+Cl2=MgCl2+Br2,
出现白色沉淀,MgBr2+2NaOH=Mg(OH)2↓+2NaBr
6.(SCN)2+2NaOH=NaSCN+NaSCN+NaSCNO+H2O
7.X Z Q Y G ,X.
8.10.85%
9.HCl:7.3%,NaCl:11.7%
10.提示:![]()
![]()
所以 355∶135=2.63∶1