高一化学提高测试4
一、选择题
1.现在含元素硒的保健品已流入市场。已知它与氧同主族,有4个电子层,则下列关于硒的叙述中不正确的是 ( )
A.核电荷数为24 B.最高价氧化物SeO3
C.非金属性比溴弱 D.气态氢化物为H2Se
2.将5.6 g铁粉与1.6 g硫粉的混合物隔绝空气加热,充分反应后冷却至室温,然后再与足量稀硫酸反应,生成气体在标准状况下的体积为 ( )
A.2.24 L B.1.12 L C.0.56 L D.0.224 L
3.下列各组物质中,互为同素异形体的是 ( )
A.石墨和金刚石 B.水和重水(D2O) C.氕和氘 D.氧气和臭氧(O3)
4.已知SO2 + Cl2 + 2H2O ==== H2SO4 + 2HCl,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质 ( )
A.立即褪色 B.慢慢褪色
C.先褪色,后复原 D.颜色不褪
5.用1 mol/L的亚硫酸钠溶液30 mL恰好将2×10–3 mol 的XO4–离子还原,则元素X在还原产物中的化合价是 ( )
A.+1价 B.+2价 C.+3价 D.+4价
6.X(盐)和Y(酸)反应,可放出有气味的气体Z;Z跟NaOH反应又得到X(盐);Z氧化的最终产物为W;W溶于水又得到Y(酸)。则X(盐)和Y(酸)是 ( )
A.Na2S和稀硫酸 B.Na2SO3和盐酸
C.Na2S和盐酸 D.Na2SO3和稀硫酸
7.下列反应中通入的气体物质,只作氧化剂的是 ( )
A.二氧化硫通入氢硫酸中 B.氯气通入NaOH溶液中
C.少量氯气通入氯化亚铁酸性溶液中 D.硫化氢通入溴水中
8.室温密闭容器中,将24 mL H2S和30 mL O2燃烧,冷却后恢复到原来状态,密闭容器内压强是原压强多少倍 ( )
A.0.33倍 B.0.44倍 C.0.37倍 D.0倍
9.将x mol Na2SO3和y mol Na2S溶于水中,用H2SO4酸化后:
![]()
![]()
![]()
![]()
![]()
![]() ①若生成硫和二氧化硫,②若生成硫和硫化氢,③若只生成硫。则x、y的比值依次为 ( )
①若生成硫和二氧化硫,②若生成硫和硫化氢,③若只生成硫。则x、y的比值依次为 ( )
A.大于 ,等于 ,小于 B.大于 ,小于 ,等于
![]()
![]()
![]()
![]()
![]()
![]() C.等于 ,大于 ,小于 D.小于 ,等于 ,大于
C.等于 ,大于 ,小于 D.小于 ,等于 ,大于
10.浓硫酸能使石蕊试纸变红,后来又变黑,这是因为浓H2SO4具有 ( )
A.酸性和吸水性 B.强氧化性
C.酸性和脱水性 D.脱水性和强氧化性
11.能够确定溶液中一定含有SO42–的实验事实是 ( )
A.取少量试样溶液,加入用盐酸酸化的BaCl2溶液,溶液中有白色沉淀生成
B.取少量试样溶液,加入BaCl2溶液,有白色沉淀,再加稀硝酸,沉淀不溶解
C.取少量试样溶液,加入Ba(NO3)2溶液,有白色沉淀生成
D.取少量试样溶液,加入足量盐酸无沉淀,加入BaCl2溶液,有白色沉淀生成
12.足量浓硫酸与m g铜完全反应得到标况下n L SO2,则被还原的硫酸是 ( )
A.m /64 mol B.64 m/22.4 mol C.98 n/22.4 g D.64 n/22.4 g
13.足量的锌和下列酸反应,产生氢气物质的量最多的是 ( )
A.18.4 mol/L H2SO4,10 mL B.2 mol/L H2SO4,30 mL
C.5 mol/L HNO3,30 mL D.3 mol/L HCl,30 mL
14.50 mL 18 mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量是
( )
A.等于0.9 mol B.大于0.45 mol,小于0.9 mol
C.等于0.45 mol D.小于0.45 mol
15.密度为1.45 g/cm3的H2SO4溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止。已知沉淀的质量与原H2SO4溶液的质量相等,则原H2SO4溶液的浓度为 ( )
A.29.6% B.42.1% C.14.8 mol/L D.6.2 mol/L
16.你认为减少酸雨产生的途径可采取的措施是⑴少用煤作燃料⑵燃料脱硫⑶在已酸化的土壤中加石灰⑷开发新能源 ( )
A.⑴⑵ B.⑵⑶⑷ C.⑴⑵⑷ D.⑴⑵⑶⑷
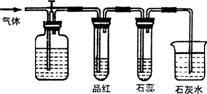 17.如图所示,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊。若打开活塞,则品红褪色,石蕊试液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是 ( )
17.如图所示,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊。若打开活塞,则品红褪色,石蕊试液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是 ( )
A.H2S和浓H2SO4
B.SO2和NaHCO3
C.Cl2和NaHCO3
D.Cl2和氨水
18.酸雨的形成主要是由于 ( )
A.森林遭到乱砍滥伐,破坏了生态平衡
B.工业中大量燃烧含硫燃料
C.大气中二氧化碳的含量增多
D.汽车排出大量尾气
19.1952年12月5日~8日发生过震惊世界的“伦敦烟雾”事件,惨案中死亡人数4千多人。其原因是工厂和居民大量燃烧煤,大量飘尘和有害气体污染空气的结果。其中主要污染物是 ( )
A.CO2 B.CO C.SO2 D.CH4
20.检验SO2中是否含有CO2,应采取的方法是 ( )
A.通过石灰水
B.通过品红溶液
C.先通过小苏打溶液,再通过石灰水
D.先通过酸性KMnO4溶液,再通过石灰水
二、填空题
21.将NaHSO4和NaHCO3两种溶液混合时,可能观察到的现象是________________,反应的离子方程式是________________________________________。
22.有一瓶无色气体,可能含有CO2,HBr,HCl,SO2中的一种或几种。将气体通入适量氯水中。得无色透明溶液,继续向该溶液中加入少量BaCl2溶液和盐酸,则产生白色沉淀。原气体中肯定含有______,肯定不含有______,可能含有____________。
23.过氧化氢(H2O2)的水溶液俗名双氧水,医疗上用作外科消毒剂。
⑴将双氧水加入经酸化的KMnO4溶液中,溶液的紫红色消褪了,此时双氧水表现出________性。
⑵向含有酚酞的NaOH稀溶液中滴入双氧水,溶液由红色褪至无色;再向溶液中加入足量的NaOH溶液,溶液始终不再显红色,主要原因是双氧水具有________性。
24.亚硫酸钠中有+4价硫,它既有氧化性,又有还原性,现有试剂溴水、硫化钠溶液、Na2SO3溶液、稀H2SO4、NaOH溶液、氨水。
⑴要证明Na2SO3具有还原性,应选用的试剂是______,看到的现象是______。反应离子方程式为______________________________。
![]() ⑵要证明Na2SO3具有氧化性,应选用的试剂有______,看到的现象是______。反应离子方程式为______________________________。
⑵要证明Na2SO3具有氧化性,应选用的试剂有______,看到的现象是______。反应离子方程式为______________________________。
三、实验题
25.图示为一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体。供选用的试剂有:
A.浓H2SO4 B.浓盐酸 C.食盐
D.MnO2 E.H2O2 F.KClO3 G.KMnO4溶液
试回答:
⑴若要快速制备少量氧气,应选择__________(填答案标号)。
⑵若要快速制备少量HCl,应选择__________。
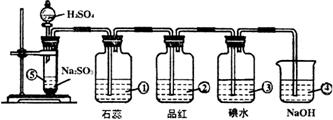 26.下图是实验室制SO2并验证SO2某些性质的装置图(设二氧化硫能够依次通过)。试回答:
26.下图是实验室制SO2并验证SO2某些性质的装置图(设二氧化硫能够依次通过)。试回答:
⑴⑤中发生的化学反应方程式为______________________________。
⑵①中的实验现象为__________,此实验证明SO2是__________气体。
⑶②中的品红溶液__________,证明SO2有__________。
⑷③中的现象__________,证明SO2有__________性。
⑸④的作用__________,反应的化学方程式为______________________________。
四、计算题
27.取50.0 mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀HNO3处理后沉淀量减少到4.66 g,并有气体放出。试计算:
⑴原混合溶液中Na2CO3、Na2SO4的物质的量浓度。
⑵产生的气体在标准状况下的体积。
28.用36.5%(密度为1.18 g/cm3)的盐酸与足量的MnO2反应,将生成的气体通入500 mL Na2SO3溶液中,气体被吸收了90%,并同时收集到8.46 L(标准状况)混合气体。向该溶液中加入少量的4 mol/L BaCl2溶液200 mL,过滤,再向溶液中加入足量AgNO3溶液,结果得到干燥的白色沉淀430.5 g。试求:
⑴有多少毫升盐酸被氧化?
⑵原Na2SO3溶液的物质的量浓度是多少?
参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | A | A、D | D | D | A、D | A、C | A | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | A、C | B | D | B、D | C | B | B、D | C | D |
二、填空题
21.产生无色气体;H+ + HCO3–= H2O + CO2↑
22.SO2;HBr;HCl、CO2
23.还原;氧化;
24.⑴溴水;溴水褪色;SO32- + Br2 + H2O = SO42- + 2 H+ +2 Br -
⑵硫化钠溶液,出现淡黄色浑浊;SO32- +2 S-+ 6 H+ = 3 S↓+ H2O
25.⑴D、E;⑵A、B。
26.⑴Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑;
⑵变红,酸性;
⑶褪色,漂白性;
⑷褪色,还原性;
⑸吸收多余的SO2,SO2 + 2NaOH = Na2SO3 + 2H2O
27.⑴![]() mol/L
mol/L ![]() mol/L
mol/L
⑵![]() L
L
28.被氧化的盐酸![]() mL,
mL,![]() mol/L
mol/L