高一上学期期中考试化学试题
时间:90分钟 满分:100分
班级: 姓名 得分
一、选择题(每小题只有一个正确选项,每题3分,共60分)
1.“酸雨”使森林死亡,湖泊酸化,古迹毁坏等,“酸雨”对人类生存的危害越来越清楚地显现在我们面前,造成“酸雨”的主要原因是 ( )
(A)大量燃烧含硫燃料,冶炼含硫矿物等 (B)土壤的沙化、植被的破坏
(C)过度排放城市污水 (D)大量丢弃废塑料
2.下列反应属于氧化还原反应的是 ( )
(A)3CuO + 2NH3 = 3Cu + N2↑+ 3H2O (B)NaOH + HCl ==NaCl +H2O
( C ) SO3 + H2O== H2SO4 (D)CaO + H2O = Ca(OH)2
3.下列燃料中,不属于化石燃料的是 ( )
(A)汽油 (B)煤 (C)天燃气 (D)氢气
4.下列反应不属于置换反应的是 ( )
(A)3Fe + 4H2O![]() Fe3O4 + 4H2↑
(B)4NH3 +3O2(纯)
Fe3O4 + 4H2↑
(B)4NH3 +3O2(纯) ![]() 2N2 +
6 H2O
2N2 +
6 H2O
(C)2Al +2NaOH+2H2O==2NaAlO2+3H2↑ (D)CuO +CO ![]() Cu + CO2
Cu + CO2
5.下列实验操作中,不正确的是 ( )
(A) 使用酒精灯前,先向灯里添满酒精
(B) 给试管里的液体加热,液体体积不超过试管容积的1/3
(C) 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入盛水的烧杯中
(D) 用漏斗过滤时,液面低于滤纸的边缘
6.某非金属元素X的最高化合价为+m,其最高价氧化物所对应水化物的分子中有b个氧原子,
则这种最高价氧化物对应水化物的分子式为 ( )
(A)Hm+2bXOb (B)Hm-2bXOb (C)H2m+bXOb (D)H2b-mXOb
7.配制一定质量分数的稀硫酸,量筒放平稳且面对刻度线。量取浓硫酸时视线仰视,量水时视线俯视,则所配制的稀硫酸实际的质量分数将 ( )
(A)偏低 (B) 偏高 (C) 不受影响 (D) 难判断
8.下列叙述中正确的是 ( )
(A) 含最高价元素的化合物,一定具有强氧化性
(B) 阳离子只有氧化性,阴离子只有还原性
(C) 失电子越多,还原性越强
(D) 强氧化剂与强还原剂不一定能发生氧化还原反应
9.有下列氧化还原反应:
① Fe + CuSO4== Cu + FeSO4
② Cu +2FeCl3== CuCl2 +2FeCl2
③ 2KMnO4 +16HCl ==2KCl +2MnCl2 +5Cl2↑+ 8H2O
④ 2FeCl2 + Cl2 ==2FeCl3
根据上述反应可判断各粒子的氧化性由强到弱的顺序正确的是 ( )
(A) MnO4-﹥Cl2﹥Fe3+﹥Cu2+﹥Fe2+
(B) Cl2﹥MnO4-﹥Cu2+﹥Fe2+﹥Fe3+
(C) MnO4-﹥Fe3+﹥Cu2+﹥Cl2﹥Fe2+
(D) Fe3+﹥MnO4-﹥Cl2﹥Cu2+﹥Fe2+
10.20g纯碱和小苏打的混合物,加热到恒重时,产生4.4gCO2,则在混合物中,纯碱的质量分数是 ( )
(A)84﹪ (B) 8.4﹪ (C) 16﹪ (D) 1.6﹪
11.钠和钾组成的合金4.6g,与足量的水充分反应,得到H2的质量可能是 ( )
(A)0.29g (B) 0.18g (C) 2g (D)1 g
12.下列物质加入水中显著放热的是 ( )
(A)固体NaCl (B)生石灰 (C)无水乙醇 (D)固体NH4NO3
13.下列各组离子能在溶液中大量共存的是 ( )
(A)Na+、H+、Cl-、HCO3- (B)Na+、Ca2+、HCO3-、OH-
(C ) Fe3+、Cl-、OH-、K + (D)Cu2+、Cl-、SO42-、K+
14.下列离子方程式中错误的是 ( )
(A) 铁与稀硫酸反应: 2Fe + 6H+==2Fe3+ +2H2↑
(B) 醋酸跟苛性钾溶液反应: CH3COOH + OH- == CH3COO- +H2O
(C) 碳酸镁跟硫酸反应: MgCO3 + 2H+ == Mg2+ +H2O + CO2↑
(D) 碳酸氢钙溶液跟盐酸反应:HCO3- + H+ == CO2↑ + H2O
15.铁粉中混有少量氧化铜杂质,把这种铁粉放到一定量的稀硫酸中,充分反应后,发现容器底部尚有铁粉剩余,则存在于溶液里的金属阳离子 ( )
(A)肯定是Cu2+和Fe2+ (B)肯定是Cu2+,可能有Fe2+
(C )肯定是Fe2+,可能有Cu2+ (D)肯定是Fe2+,没有Cu2+
16.以下各物质的性质比较中,正确的是 ( )
(A)热稳定性:Na2CO3﹥NaHCO3﹥H2CO3 (B)溶解度Na2CO3﹤ NaHCO3﹤H2CO3
(C)碱性 RbOH﹤KOH﹤LiOH (D)氧化性Rb+﹥K+﹥Na+
17.在一定条件下NH4NO3受热分解,其化学方程式为:5 NH4NO3 ![]() 2HNO3+ 4N2 +9H2O
2HNO3+ 4N2 +9H2O
在反应中被氧化与被还原的氮原子数之比为 ( )
(A)3 :5 (B) 5 :3 (C) 1 :1 (D) 5 :4
18.有一瓶不饱和的NaOH溶液,平均分成四等份,在温度不变的条件下,分别加入下列固体中的一种,使溶液达到饱和,则加入物质的质量最大的是 ( )
(A)Na (B) Na2O (C) NaOH (D) Na2O2
19.元素X是一种碱金属,下列关于X及其化合物的说法,不正确的是 ( )
(A) 无水硫酸盐的化学式是X2SO4
(B) 其氢氧化物是一种强碱
(C) 其单质是一种良好的还原剂
(D) 其单质可以由对应的氧化物与焦炭加热而制得
20.向下列溶液中通入过量CO2,有固体析出的是 ( )
①Ba(NO3)2 ②Na2CO3 饱和溶液 ③氨化的饱和食盐水 ④CaCl2
(A)全部 (B) ②③ (C) ③④ (D) ①④
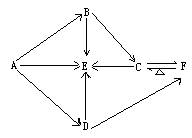
二、填空题(共25分)
21.按下图所示各步变化中,A为金属,B为淡黄色固体粉末,且每一种物质均含有A元素。D的水溶液跟AgNO3溶液反应生成不溶于稀HNO3的白色沉淀。请完成下列问题。
(1)推断(写化学式) E F 。
(2)完成下列反应的方程式,是离子反应的请写出离子方程式,是氧化还原反应的请标出电子转移的方向和数目。
![]() A E
A E
22.回答下列问题:
(1) 钠为什么不能保存在汽油中?
(2) H+为什么能与OH-发生中和反应?
(3) 碳的燃烧为什么是放热反应?
(4) 酒精的水溶液为什么不导电?
23.在进行有关燃料充分燃烧的条件讨论时,有两种意见:
甲同学认为:空气多好;
乙同学认为:空气要适量。
你认为上述哪位同学的意见不正确?理由是什么?
答:
三、实验题(共15分)
24.有H2SO4、NaHCO3、BaCl2、Na2SO4四种溶液,分别盛于编号为A、B、C、D的四支试管中,进行如下所示的实验,据此现象,试确定B、C、D各是什么物质,并回答下列问题。
| 实验 | 反应现象 | 结论 |
| A+B | 产生无色气体 | B是 |
| A+C | 无明显现象 | C是 |
| A+D | 产生白色沉淀 | D是 |
(1)B是 ,C是 ,D是 。
![]()
![]() (2)写出A +B ,A + D 两反应的离子方程式。
(2)写出A +B ,A + D 两反应的离子方程式。
![]() A +B
A +B
![]() A +D
A +D
25、(1)检验NaCl溶液中有Na2CO3的试剂是 ;检验NaHCO3溶液中有Na2CO3的试剂是
(2)检验Na2CO3固体中含有NaHCO3的方法是
答案:一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | D | D | A | D | B | D | A | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | B | D | A | D | A | B | C | D | B |
二填空题
21、(1) E: NaOH ; F : NaHCO3
(2) 失2×e-
![]()
![]() 2Na + 2H2O ===
2Na+ + 2OH- +
H2↑
2Na + 2H2O ===
2Na+ + 2OH- +
H2↑
得2×e-
22.(1)因汽油易挥发
(2)二者反应生成难电离的水
(3)因碳和O2的总能量大于CO2的能量
(4)酒精是非电解质在水中不能电离出自由移动的离子。
23.甲同学意见不正确,因为空气过多时,多余的空气会带走热量。
24、(1)B :NaHCO3 C;Na2SO4 D:BaCl2
(2)HCO3- + H+ == CO2↑ + H2O ; Ba2+ +SO42- == BaSO4↓
25.(1)盐酸;CaCl2或BaCl2溶液 ;(2)取少量固体放在试管中加热将产生的气体通入澄清石灰水,石灰水变浑浊。