高一化学第一学期期末考试试卷
可能用到的相对原子质量:H -1 C- 12 N- 14 O- 16 He- 4 Na- 23 S- 32 Cl- 35.5 Ca- 40
Fe -56 Zn -65 Ag -108 Ba -137
一、选择题:(本题共22小题,普通中学做1~20题,重点中学做1~18、21、22题。共60分,每小题只有一个正确答案)
1、下列燃料中,不属于化石燃料的是(
)
A、煤矿 B、石油 C、天然气 D、水煤气
2、实验室收集Cl2,最好选用( )
A、向上排空气法 B、向下排空气法 C、排水法 D、排饱和食盐水法
3、在下列各组物质中,只有还原性的是( )
A、Na Cl- S2- B、Cl- CO
Na+
C、Fe3+ SO42- NO3- D、Fe2+
O2 H2S
4、见光能分解的盐是( )
A、HClO B、AgBr C、氯水 D、Ca(ClO)2
5、为高空或海底作业提供氧气的物质是( )
A、KClO3 B、KMnO4 C、Na2O2 D、H2O
6、下列物质的保存方法不正确的是( )
A、新制氯水应密封保存
B、盛液溴的试剂瓶常加少量水
C、少量的金属钠应保存在煤油中
D、固态碘放在棕色细口瓶中
7、下列叙述正确的是(
)
A、1mol任何气体的体积一定是22.4L
B、同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C、在标准状况下,体积为22.4L的物质都是1mol
D、在非标准状况下,1mol任何气体的体积不可能是22.4L
8、用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是(
)
A、干燥的 B、瓶塞不漏水的
C、用欲配制的溶液润洗过的 D、以上三项均须要求的
9、被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)( )
A、NaBH4既是氧化剂又是还原剂 B、NaBH4是氧化剂,H2O是还原剂
C、硼元素被氧化,氢元素被还原 D、被氧化的元素与被还原的元素质量比为1:1
10、用自来水养金鱼,在将水注入鱼缸之前,常需把水在阳光下晒一段时间,主要目的是( )
A、增加水中氧气的含量 B、起杀菌作用
C、使水中的次氯酸分解 D、使水的温度升高
11、下列各溶液中,Na+物质的量浓度最大的是(
)
A、4L0.5mol/LNaCl溶液 B、1L0.3mol/LNa2SO4溶液
C、5L0.4mol/LNaOH D、2L0.15mol/LNa3PO4
12、做焰色反应实验时所用的铂丝,每次用毕后都要( )
A、用水多洗几次 B、先用稀盐酸洗,再用水洗
C、用稀盐酸洗 ,再在火焰上灼烧到没有什么颜色为止
D、放在火焰上灼烧,直到铂丝发红为止
13、下列关于新制氯水及久置氯水的说法,不正确的是( )
A、新制的氯水呈黄绿色,久置的氯水无色
B、新制的氯水漂白作用强,而久置的氯水漂白作用很弱
C、新制的氯水所含成分多,而久置的氯水所含成分少
D、新制的氯水中无氯离子,而久置的氯水中则含氯离子
14、下列离子方程式中,书写不正确的是( )
A、氯化钠溶液中加入硝酸银溶液:Ag+ + Cl-
= AgCl↓
B、把金属钠放入水中:Na + 2H2O = Na+ +2OH- + H2
C、将溴水加入碘化钾溶液中:Br2 + 2I-
= 2Br- + I2
D、盐酸滴在石灰石上:CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O
15、下列各组离子中,能在溶液中大量共存的是( )
A、H+、Ca2+、Cl-、CO32- B、I-、ClO-、K+、H+
C、Na+、Fe3+、SO42-、OH- D、Na+、Cu2+、Cl-、SO42-
16、将同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-完全沉淀,则需同物质的量浓度的AgNO3溶液的体积比为( )
A、1∶2∶3 B、 3∶2∶1 C、1∶1∶1 D、6∶3∶2
17、血红蛋白的相对分子质量约为68000,已知其中含铁0.33%,则平均每个血红蛋白的分子中铁原子数约为(
)
A、5 B、4 C、3 D、2.408×1024
18、同温同压下,氦气、氢气和氨气的体积比为3∶2∶1,则其原子个数比为 ( )
A、1∶2∶3 B、4∶3∶3 C、3∶4∶4 D、3∶2∶1
19、含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是( )
A、②④ B、①③ C、②③ D、①④
20、把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(标准状况),则这3.36L气体的质量是( )
A、3.8g B、5.6g C、4.8g D、6.0g
21、将H2、O2、Cl2三种气体,按质量比为18∶128∶71混合,盛在密闭容器中用电火花引爆,充分反应后经冷却、液化,所得溶液中溶质的质量分数为( )
A、37% B、 33.6% C、18.5% D、16.8%
22、在150℃ 时使NH4HCO3 分解,将所产生的气体依次通过Na2O2和浓H2SO4,则Na2O2增重ag,浓H2SO4增重bg;若将上述气体先通过浓H2SO4,则使酸液增重dg,再通过Na2O2 ,则使之增重cg。设气体皆完全被吸收,a、b、c、d质量由大到小的排列顺序正确的是( )
A、d a c b B、b c a d C、a c b d D、d c b a
二、填空题:(本题共4小题,共26分。)
23、(4分)在下列物质:烧碱,NH3·H2O,SO3,铁片,石墨,甲烷,醋酸,碳酸钙中,属于电解质的是_______ _____,其中属于强电解质的是__ ____,既不属于电解质又不属于非电解质的是___________。
24、(3分)用双线桥法表示下列氧化还原反应,并指出氧化剂。
MnO2 + 4HCl(浓) = MnCl2 + 2H2O
+ Cl2↑ 氧化剂
。
25、(5分)在某澄清溶液中,可能存在下述几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下述实验:(1)用pH试纸检验,该溶液呈强酸性;(2)取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;(3)另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。根据上述实验现象,推断原溶液中肯定存在的离子是 ,肯定不存在的离子是 ,可能存在的离子是 。你推断的理由是 。
26、区某工厂,在山坡坑道的仓库里贮有氯气钢瓶。一天一只贮有氯气的钢瓶损坏,造成氯气泄露,在场工人采取以下措施,请选择填充并简述理由。
(1)处理钢瓶的方法正确的是 ,简述理由
A、瓶推到坡下的小河里 B、把钢瓶丢到深坑里,用石灰填埋 C、把钢瓶扔到农田中。
(2)钢瓶处理后,工人应 ,简述理由
A、转移到坡下 B、转移到坡上
27、(10分)实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体_______g
(2)若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_________(同一步骤可用多次)
A、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量 D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果.
(4)配制Na2CO3溶液时需用的主要仪器有____________________
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、加水时越过刻度线_________ B、忘记将洗涤液加入容量瓶__________
C、容量瓶内壁附有水珠而未干燥处理______ D、溶解后没有冷却便进行定容_____
三、计算题:(本题共3小题,普通中学做28~29题,重点中学做28、30题。共13。)
28、(7分)实验室里用二氧化锰与浓盐酸反应来制取适量的氯气。现用100ml的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,计算:(1)理论上需要参加反应的二氧化锰多少克?(2)浓盐酸的物质的量浓度为多少?(3)被氧化的HCl的质量为多少克?
29、(7分)在100ml 0.5mol/L的NaOH溶液中通入一定量的CO2,测得反应后的溶液中CO32-和HCO3-的物质的量浓度之比为1∶3,则通入的CO2气体在标准状况下的体积是多少ml?
30、(7分)将表面被氧化为Na2O、Na2O2的金属钠1.1g投入水中,收集到224mL气体(标准状况),该气体引爆后,冷却到原状态时,剩余气体为56mL。则Na、Na2O、Na2O2的质量分别为多少克?
高一化学第一学期期末考试试卷
答 案 纸
一、选择题:(本题共22小题,普通中学做1~20题,重点中学做1~18、21、22题。共60分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
二、填空题:(本题共4小题,共26分。)
23、(2+1+1,共4分)
24、(双线桥2分,氧化剂1分,共3分)
MnO2 + 4HCl(浓) = MnCl2 + 2H2O + Cl2↑ 氧化剂
25、(5分)肯定存在的离子是 ,肯定不存在的离子是 ,可能存在的离子是 。你推断的理由是 。
26、(每格2分,共4分)(1) 、 。
(2) 、 。
27、(1、2、5每格1分,3、4每格2分,共10分)
(1)
(2)
(3)
(4)
(5)A、
B、
C、
D、
三、计算题:(本题共3小题,普通中学做27~28题,重点中学做27、29题。共14分。)
27、(7分)解:
28、(7分)解:
29、(7分)解:
第一学期期末考试高一化学试卷
答 案 纸
一、选择题:(本题共22小题,普通中学做1~20题,重点中学做3~22题。共60分,每小题只有一个正确答案)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | D | A | B | C | D | B | B | D | C | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | D | B | D | A | B | C | B | D | B | A |
二、填空题:(本题共4小题,共26分。)
23、(2+1+1,共4分)烧碱 NH3·H2O 醋酸 碳酸钙 烧碱 碳酸钙 铁片 石墨
|
|
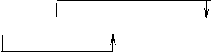
MnO2 + 4HCl(浓) = MnCl2 + 2H2O + Cl2↑ 氧化剂 MnO2
25、(1+1+1+2,共5分)H+、I-、Ba2+, CO32-、SO42-, K+。理由:根据(1)推断有H+,而无CO32-,因H+ 与CO32 -不共存;根据(2)推断有I-,因I-被Cl2置换生成I2,I2被四氯化碳萃取使四氯化碳层呈紫红色;根据(3)推断有Ba2+,因为白色沉淀为BaCO3,则无SO42-,SO42-与Ba2+不共存;K+没有可用于断定的现象,故可能存在。
26、(每格2分,共4分)(1)B、氯气与石灰反应生成无毒物质;(2)B、Cl2的密度比空气大,会往下沉。
27、(1、2、5每格1分,3、4每格2分,共10分)
(1)14.3 (2)13.7 (3)BADFCFE
(4)500mL容量瓶 托盘天平 玻璃棒 胶头滴管 烧杯
(5)A、偏低 B、偏低 C、不变 D、偏高
三、计算题:(本题共3小题,普通中学做27~28题,重点中学做28~29题。共14分。)
27、(7分)(1)21.75g (2)10mol/L (3)18.25g
28、(7分)896ml
29、(7分)m(Na)=0.345g m(Na2O)=0.365g m(Na2O2)=0.39g
或m(Na)=0.23g m(Na2O)=0.09g m(Na2O2)=0.78g