高一级上期期末化学试卷
说明:
1. 本试卷分第I卷和第II卷,将第I卷的正确选项的代号填写在第II卷前面的答题栏内,第II卷用钢笔或圆珠笔直接答在试题卷上。
2. 本试卷满分100分,90分钟完卷。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 S-32 Cl-35.5 K-39 Mn-55 Br-80
第I卷(选择题 共46分)
一、选择题(本大题包括23小题,每小题2分,共46分。每小题只有一个选项符合题意)
1. 下列燃料中,不属于化石燃料的是
A.煤 B. 石油 C.天然气 D.酒精
2. 下列科学家对中国的化工事业作出巨大贡献的是
A.戴维 B.袁隆平 C.候德榜 D.李四光
3. 下列化学反应中,属于吸热反应的是
A.金属钠与水反应 B.过氧化钠
C.金属铝与盐酸反应 D.氢氧化钡晶体与氯化铵晶体反应
4. 氯酸钾与氧化铜组成的混合物受热能产生氧气,其中氧化铜的作用是
A.氧化剂 B.催化剂 C.还原剂 D.吸收剂
5. 下列物质属于电解质的是
A.石墨 B.石灰水 C.二氧化硫 D.BaSO4晶体
6. 同温同压下,两种气体的体积如果不同,其主要原因是
A.气体的分子大小不同 B.气体分子间的平均距离不同
C.气体的性质不同 D.气体的物质的量不同
7. 以NA表示阿伏加德罗常数,下列说法中正确的是
A. 1mol硫酸的质量是98g,其中所含氢原子数目为2NA
B. 1molCl2中所含氯原子的数目为2mol×NA
C. 将40g氢氧化钠溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L
D. 标准状况下,22.4L氢气和氧气的混合气体,其平均摩尔质量为10
8. 实现下列变化必须加入氧化剂的是
A.Na2O→NaOH B.P→PCl5 C.Cl2→NaClO D.NaHCO3→Na2CO3
9. 下列反应中属于氧化还原反应的是
A. Na2O + H2O = NaOH B. 2F2 + 2H2O = 4 HF + O2
C.Cl2 + H2O = HClO + HCl D. 2Na + 2H2O = 2 NaOH +H2↑
10. 下列叙述中正确的是
A. 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B. 没有单质参加的反应一定不是氧化还原反应
C. 置换反应一定是氧化还原反应
D. 失去电子难的原子容易获得电子
11. 下列反应的离子方程式中正确的是
A. Ba (OH)2溶液与足量稀硫酸反应:Ba2+ + SO42- = BaSO4↓
B. 金属钾投入水中:K + H2O = K+ + OH- +H2↑
C.
浓盐酸和二氧化锰共热 :MnO2 + 2H+ +
2Cl- ![]() Mn2+ + Cl2↑+ H2O
Mn2+ + Cl2↑+ H2O
D. CO2通入漂白粉溶液: CO2 + Ca2+ + 2ClO- + H2O = CaCO3 ↓+ 2HClO
12. 下列各组离子,能在溶液中大量共存的是
A. CO32-、 Ag+、 Na+、 Br- B.H+ 、K+ 、ClO- 、NO3-
C.Cu2+、 K+ 、SO42- 、Cl- D. Ba2+ 、K+、SO42-、Cl-
13. 将一条湿润的蓝色石蕊试纸投入盛有氯气的集气瓶中,试纸将
A.不变色 B.由蓝色变紫色
C.由蓝色变红色 D.由蓝色变红色再变白
14. 将一小块金属钠投入盛有5mL饱和澄清石灰水的试管中,不可能观察到的现象是
A.钠熔化成小球在液面上游动 B.发出“嘶嘶”的声音
C.溶液由无色变为红色 D.溶液变浑浊,静置后试管底部有白色不溶物
15. 同温同压下,A容器中的H2和B容器中的NH3所含的氢原子数目相等,则两容器的体积比为
A. 2:1 B. 1:2 C.3: 2 D. 2:3
16. 在含有KBr和NaI的混合溶液中通入过量Cl2充分反应后,将溶液蒸干,并将剩余残渣灼烧,最后留下的物质是
A.KCl B. KCl 和NaBr C. KCl 和KBr D.KCl 和NaCl
17. 下列氯化物中,能直接利用金属与稀盐酸反应得到的是
A.FeCl3 B.FeCl2 C. CuCl2 D.AgCl
18. 等质量的下列物质其物质的量由大到小的顺序是
① NaOH ②Na2O ③ Na2O2 ④Na2CO3
A. ①②③④ B. ④③②① C. ①②④③ D. ④③①②
19. 在电解质溶液中,一定相等的是
A. 阴离子数和阳离子数
B. 阳离子的正电荷总数与阴离子的负电荷总数
C. 阴离子的质量与阳离子的质量
D. 每个阳离子与每个阴离子所带的电荷数
20. 下列说法不正确的是
A.工业上用Cl2和石灰水制取漂白粉 B.铜丝在Cl2中燃烧产生棕黄色的烟
C.Br2是常温下呈液态的非金属单质 D.淀粉溶液遇I2变蓝
21. 下列实验操作能达到目的的是
A. 用托盘天平称量25.20g氯化钠固体
B. 用100mL量筒量取2.50mL稀盐酸
C. 实验需150mL 0.1mol/L盐酸,用250mL的容量瓶配制
D. 将干燥的氯气与红色布条接触,验证氯气的漂白性
22. 将一定量的NaHCO3和Na2CO3的混合物加热到不再产生气体时,收集到CO2 aL,冷却后向残余物中加入足量盐酸又收集到2aL(气体体积均在标准状况下测得)。则混合物中NaHCO3和Na2CO3的物质的量之比是
A. 1 :1 B. 1 :2 C.1 :3 D. 2 :1
23. 在200℃时,11.6gCO2和H2O(气)的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均相对分子质量为
A. 5.6 B. 16.2 C . 23.2 D. 46.4
高一级上期期末考试
化学试卷
第I卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 |
第II卷(非选择题 共54分)
二、实验题(本大题包括2小题 ,共16分)
24.(6)分某同学拟用H2SO4的质量分数为98%的浓硫酸(p=1.84g/cm3)配制1mol/L的稀硫酸100mL,请回答下列问题:
(1)应量取浓硫酸的体积为 mL。
(2)可供选择的仪器有:①玻璃棒;②胶头滴管;③100mL容量瓶;④托盘天平;⑤50mL烧杯;⑥10mL量筒;⑦100mL量筒;请选出要使用的仪器的序号: 。
(3)如果该同学在定容时俯视刻度线,其它操作均正确,则所配制溶液中H2SO4的物质的量浓度
1mol/L(填“>”、“<”或“=”)。
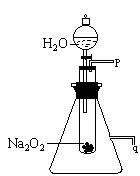 25.(10分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉燃烧起来。
25.(10分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉燃烧起来。
(1) 由实验现象所得出的有关Na2O2和H2O反应的结论是:
a.该反应放出气体的名称是 。
b.该反应是 热反应(填“吸”或“放”)。
(2) 某研究性学习小组拟用右图的装置进行实验以证明上述结论。
① 用以验证结论a的实验方法及现象是:
。
② 用以验证结论b的实验方法及现象是:
.。
三、填空题(本大题包括3小题,共25分)
26.(6分)在淀粉碘化钾溶液中滴入少量次氯酸钠溶液,并加入少量稀硫酸,溶液立即变蓝,其反应的离子方程式为 ;在上述蓝色溶液中加入足量的亚硫酸钠溶液后,蓝色逐渐消失并有硫酸根离子生成。由以上实验事实可得ClO-、I2、SO42-的氧化性由强到弱的顺序是
。
27.(12分)W、X、Y、Z四种化合物的焰色反应均为黄色,它们之间有下列变化关系:
①W ![]() X+CO2↑+H2O ②Z+CO2→X+O2
X+CO2↑+H2O ②Z+CO2→X+O2
③Z+H2O→Y+O2 ④X+Ca(OH)2(饱和石灰水)→Y+CaCO3↓
据此:W、Z的化学式分别是 、 ,反应②的化学方程式是
,反应④的离子方程式是 。
28.(7分)已知A、B、C、D四种物质的转化关系如下:
①
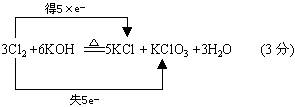
3A+6KOH(浓溶液)![]() 5B+C+H2O
5B+C+H2O
②
②C ![]() B+D↑
B+D↑
③ C + HCl (浓)→A↑ +B + H2O ,且A,D均为单质。(②③反应均末配平)
(1)由此推断A、C的化学式为:A ,C 。
(2)写出反应①的化学方程式,并标出电子转移的方向和数目:
四、计算题(本大题包括2小题,共13分)
29.(6分)将8.7gMnO2与足量的浓盐酸混合,在加热条件下,使其完全反应。计算:
(1) 所得Cl2在标准状况下的体积;
(2) 被还原的HCl的物质的量。
30.(7分)用200mL密度为1.84g/cm3 、H2SO4的质量分数为98%的浓硫酸与等体积的水混合,配得一定体积的稀硫酸。
(1)所得稀硫酸中H2SO4的质量分数是 49% (填“﹥”、“﹤”或“=”)。
(2)浓硫酸中H2SO4的物质的量浓度是多少?
级上期期未考试
化学试卷 答案:
一、选择题(本大题包括23小题,每小题2分,共46分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | C | D | B | D | D | B | B | C | C | D | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | D | C | C | D | B | A | B | A | C | B | C |
二、实验题(本大题包括2小题,共16分)
24.(6分)
(1)5.4mL (2)①②③⑤⑥ (3)﹥ (各2分)
25.(10分)
(1) 氧气 ,放 (各2分)
(2) ①反应开始后,用带火星的木条靠近P口处,若带火星的木条复燃,则说明产生的气体是氧气。(3分)
②在q处用橡胶管连接一导管,将导管的另一端浸入盛水的水槽中,反应一段时间后,若导管口有气泡逸出,则说明该反应是放热反应。(3分)
三、填空题(本大题包括3小题,共25分)
26.(6分)
2I- +ClO- + 2H+ = I2 +Cl- + H2O, ClO-﹥I2﹥SO42-(各3分)
27.(12分) (1)A:Cl2 C: KClO3(各2分)
四、计算题(本大题包括2小题,共13分)
29(6分)因为MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ +2H2O
MnCl2 +Cl2↑ +2H2O
87g 2mol 22.4L
8.7g n v
所以:(1)所得Cl2的体积:v(Cl2) =![]() =2.24L (3分)
=2.24L (3分)
(3) 还原的HCl的物质的量:n (HCl)=0.2mol (3分)
30.(7分) (1)﹥ (3分)
(2)![]() =
18.4mol/L (4分)
=
18.4mol/L (4分)
答:浓硫酸中H2SO4的物质的量浓度是18.4mol/L