高一年级化学第一学期期末考试
高 一 年 级 化 学 试 题
满分 120分 限时 90分钟 命题人 何国民 检测时间 2004年1月8日
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 I 127 Na 23 K 39 Fe 56
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1、自来水可以用氯气消毒。某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质的是( )
A.NaOH B.NaHCO3 C.AgNO3 D.FeCl3
2、用洁净的铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,这说明该溶液中金属离子是( )
A. 只有Na+ B.可能有Na+,,也可能有K+
C. 一定有Na+,,也可能有K+ D.一定有Na+,,也可能有大量Ba2+
3、在反应8NH3+ 3Cl2== 6NH4Cl+ N2中,若有1molCl2完全反应,则被氧化的NH3质量为( )
A.136g B.45.3g C.34g D.11.3g
|
![]() A. 2F2+2H2O====4HF+O2↑
B. C+H2O CO+H2
A. 2F2+2H2O====4HF+O2↑
B. C+H2O CO+H2
C. 2Na+2H2O====2NaOH+H2↑ D. Cl2+H2O====HCl+HClO
5、下列说法正确的是( )
A. 要加热才能进行的反应一定是吸热反应
B. 石墨转化为金刚石的反应是吸热反应,由此可以判断金刚石比石墨稳定
C. 甲烷的燃烧是放热反应
D.为了使燃料充分燃烧,空气越过量越好
6、体积为1L的干燥容器内充入HCl气体后,测得容器中气体对氧气的相对密度为1.082,用此气体进行喷泉实验,当喷泉停止后,进入容器中水的体积是( )
A.0.25L B.0.50L C.0.75L D.1.0L
7、下列电离方程式错误的是( )
①NaHCO3 ═ Na++H++CO32- ②NaHSO4=Na++H++SO42-
③H2SO4=2H++SO42- ④KClO3=K++Cl-+3O2-
A.①② B.① C.③④ D.①④
8、下列反应既是离子反应,又是氧化还原反应的是( )
① 二氧化硫与硫化氢作用生成硫和水
③ 二氧化硫与氢氧化钠溶液作用生成亚硫酸钠和水
③ 硫化氢气体通入氯化铁溶液中生成硫、氯化亚铁和盐酸
④ Zn粒与稀硫酸反应制取氢气
A.①② B.①④ C.②③ D. ③④
9、下列各组物质中的两种物质作用时,反应条件或反应物的用量改变,对生成物没有影响的是( )
A. 过氧化钠和二氧化碳 B.钠和氧气
C.氢氧化钠和二氧化碳 D.碳和氧气
10、下列离子反应方程式不正确的是( )
A. 氢氧化钠溶液和硫酸反应:
H++ OH- == H2O
B. 二氧化锰和浓盐酸在加热条件下反应:
MnO2 + 4 H+ == Mn2+ + 2 H2O + Cl2 ↑
C. 氧化铜和盐酸反应:
CuO + 2 H+ == Cu2+ + 2 H2O
D. 碳酸氢钠溶液和氢氧化钠溶液反应:
HCO3- + OH- == H2O + CO32-
11、天平两托盘中各放一个烧杯,现往两烧杯中加入等物质的量浓度、等体积的稀H2SO4且天平平衡,然后一侧烧杯中加入NaHCO3,另一侧烧杯中加入Na2CO3,若加入的盐质量也相等,充分反应后,则天平最终( )
A.仍然平衡 B.加入NaHCO3的一侧重
C.加入Na2CO3的一侧重 D.无法判断
12、把金属钠投入下列物质的溶液中,溶液质量会减轻的是( )
A.HCl B.(NH4)2SO4 C.FeCl3 D.NaOH
13、在制小苏打(NaCl + CO2 + NH3 +H2O ═ NaHCO3↓ + NH4Cl )的操作中,应在饱和食盐水中:( )
A.先通入CO2达到饱和后再通入NH3
B.先通入NH3达到饱和后再通入CO2
C.CO2和NH3同时通入
D.以上三种方法都行
14、将高锰酸钾和氯酸钾的混合物加热,待完全反应后,向残余固体中加入浓盐酸并加热,在整个过程中不可能产生的气体是( )
A.氧气 B.氯气 C.氯化氢 D.氢气
15、在强酸性溶液中可大量共存的离子组是( )
A.Na+、K+、 Cl-、OH- B.Fe2+ 、ClO-、 NO3- 、 Na+ C.Fe2+、 Mg2+、 SO42-、Cl- D.CO3-、SO42-、Na+、K+
16、下列说法正确的是( )
A.漂白粉的有效成分是氯酸钠 B.碘化钾水溶液能使淀粉变蓝 C.氟气通入水中有氧气生成 D.钠投入氯化铁溶液中能置换出铁
二、(本题包括2小题,共26分)
17、(12分)实验室配制500mL0.5mol/L的NaCl溶液,有如下操作步骤:① 把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;② 把①所得的溶液小心转入 A 中;③ 继续向容量瓶中加蒸馏水至液面距刻度标线2—3cm处,改用 B 小心滴加蒸馏水至溶液凹液面最低点与刻度标线相切;④ 用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都要小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
(1) 操作步骤正确的顺序为(填序号)____________________。
(2) 上段文字中的A、B处相应的仪器应该是______ 和______,该实验用到的基本仪器还有________________________________________。
(3) 若最终定容时俯视,则所配溶液的物质的量浓度比要求配制的浓度(填“偏高”、“偏低”、或“无影响”,下同)____________。
(4) 若没有进行操作④,则所配溶液的浓度会________, 若加蒸馏水不慎超过了刻度标线,浓度会___________。
18、(14分)下图为实验室制取氯气和进行氯气性质实验的装置图,请根据该图回答下列问题:
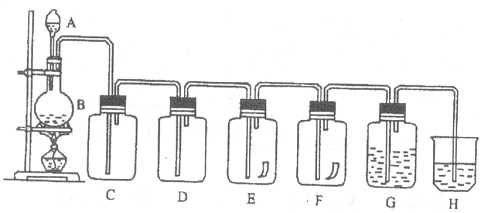
(1) 写出仪器名称:A________,B________。
(2) C装置是为了除去氯气中的氯化氢气体,C中应放入下列溶液中的____________。
a.水 b.饱和食盐水 c.氢氧化钠 d.AgNO3溶液
(3) D装置是为了干燥氯气,D中应放入下列溶液中的_________。
a.水 b.浓硫酸 c. NaOH溶液 d.饱和食盐水
(5) E中有一干燥的红色布条,反应中观察到的现象是___________________________。
(6) F中有一湿的红色布条,反应中观察到的现象是_____________________________。
(7) G中是紫色石蕊试液,反应中观察到的现象是_______________________________。
(8)
H中放入NaOH溶液,其作用是________________________。
三、(本题包括4小题,共36分)
19、(6分)变色眼镜的玻璃片内含有少量溴化银和微量氧化铜。当受到阳光照射时,发生反应的化学反应方程式为_____________________________,从而使玻璃由无色变为灰黑色。把眼镜放到暗处,又发生反应__________________________,玻璃又变为无色透明。上述过程中氧化铜的作用是_____________。
20、(6分)将以下各实验所需的试剂填写在空格中
(1) 用氯酸钾和二氧化锰加热制取氧气后的试管中,残留的黑色物质,可用_______加热洗涤。
(2) KCl中混有少量的KI要除之,方法是将其溶于水后,滴入足量_______充分反应,再加入___________振荡、静置、分液,最后将上层水溶液蒸干即得纯氯化钾。
21、(12分)
(1) 在标准状况下,1体积的水溶解了700体积的氨气,所得溶液的密度为0.9g.cm-3。则溶液的质量分数为___________,物质的量浓度为____________。
(2) agNa2O和bgNa2O2投入到等量足量的水中,得到的溶液溶质质量分数相同,则a____b(选填“>”、“=”或“<”)
22、(12分)写出下列反应的离子方程式:
① 少量的碳酸氢钠溶液与足量的氢氧化钡溶液反应:
__________________________________________________________________;
② 一小块金属钠投入到足量的硫酸铜溶液中:
__________________________________________________________________;
③ 溴化亚铁溶液中通入氯气,溴离子有一半被氧化(已知Fe2+还原性强于Br—)_________________________________。
四、(10分)
23、为了预防碘缺乏病,国家规定每千克食盐应含有40~50mg的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428g,设法溶解出其中全部的碘酸钾,将溶液酸化并加入足量的碘化钾淀粉溶液,溶液出现蓝色,当再加入0.030mol/L的硫代硫酸钠溶液18.00mL时蓝色刚好褪去。有关反应如下:
IO-3 +5I-+ 6H+ == 3I2 + 3H2O,I2 + 2S2O32- == 2I- + S4O62-。
试通过计算说明该加碘食盐是否为合格产品。
高一年级期末考试化学答卷
总分___________
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、
17、(1)____________;(2)____________ , ___________ ,_________________________;
(3)_______ ;(4)________。
18、(1)__________、___________;(2)____;(3)_____;(4)_________;(5)__________;
(6)_______________;(7)________________。
三、
19、 _________________________;_____________________________; ______________。
20、(1)_________;(2) _________ ;____________。
21、(1)________;(2)________。
22、① ______________________________________________;
② ______________________________________________;
③ ______________________________________________。
四、
23、解:
参考答案与评分标准
一、1—5: D C D D C 6—10: C D D A B 11—16: C C B D C C
二、17、(1)①②④③⑤; (2)500mL容量瓶;胶头滴管;天平、药匙、烧杯、玻璃;
(3)偏高;(4)偏低。
18、(1)分液漏斗、圆底烧瓶;(2)b;(3)b;(4)没有变化;(5)布条褪色;(6)先变红后褪色;(7)除去多余的氯气、防止空气污染。
![]()
![]() 三、
三、
19、 2 AgBr 2Ag + Br2; 2Ag + Br2 2 AgBr; 催化剂。
20、(1)浓盐酸;(2)氯水,四氯化碳或苯。
21、(1)0.35; 18.4mol/L;(2)<。
22、① Ba2+ + OH- + HCO3- == BaCO3↓+ H2O
② 2 Na + 2H2O + Cu2+ == Cu(OH)2↓+2Na+ + H2↑
③ 2Fe2+ +2 Br- + 2Cl2 ==2 Fe3+ + Br2 + 4 Cl-
四、
23、解:根据 KIO3~6K2S2O3,可得 每千克食盐中含碘酸钾的质量= 214mg×0.030mmol/mL×18mL×1000g÷6mmol×428g=45mg
所以该碘盐为合格产品。