高一年级化学教学质量检测
化学试题卷
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,上交试题卷和答题卷。
可能用到的相对原子质量:H 1 C 12 S 32 O 16 Ba 137 Na 23
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.燃烧是一种常见的现象,对于燃烧的叙述正确的是
(A)燃烧一定是有氧气参加的化学反应
(B)燃烧一定是发光、发热的剧烈的化学反应
(C)可燃物燃烧时不存在物理变化
(D)燃烧只是一种氧化反应(不存在还原反应)
2.材料是人类赖以生存和发展的物质基础,可以说,新材料的开发和应用,往往是社会发展和人类进步的一种标志。这里所说的材料是指
(A)所有自然界存在的物质 (B)金属材料和非金属材料
(C)机械强度很高的物质 (D)为人类社会所需要并能用于制造有用器物的物质
3.氢原子的电子云图中,小黑点表示的意义是
(A)一个小黑点表示一个电子 (B) 黑点的多少表示电子个数多少
(C) 表示电子运动的轨迹 (D) 电子在核外空间出现机会的多少
4.氧化铁在加热条件下能和一氧化碳发生化学反应,该反应的类型应属于
(A)复分解反应 (B)化合反应 (C)置换反应 (D)氧化还原反应
5.可用于判断某电解质是是弱电解质的依据是
(A)某电解质不是离子化合物而是共价化合物
(B)某电解质溶于水后其水溶液导电能力不强
(C)某电解质溶于水后,在水溶液中只有部分分子电离成离子
(D)某电解质常温下在水中的溶解度不大
6.煤是我国的一种主要能源,在使用煤资源时,下列所采取的措施不合理的是
(A)燃煤时应将块煤粉碎或磨成粉末 (B)燃煤时应通入足量的空气,且越多越好
(C)将煤制成水煤气 (D)将煤经过处理制成甲醇等
7.考古工作者从地下挖出一种用粘土烧制的表面较为粗糙的小罐,经测试该小罐对水有一定的渗透性,和该小罐有关的叙述错误的是
(A)这是一种陶器
(B)这是一种瓷器
(C)在我国历史上,这种质地的器皿在唐宋时期已有较高的制作水平
(D)江苏宜兴制作的这种质地的器皿在世界上享有盛誉
8.1985年科学家发现了C60分子,以后又发现了C70分子,C60和C70两者是
(A)碳的两种同位素 (B)碳的两种核素
(C)碳的两种同素异形体 (D)碳的两种不同化合物
9.在火车上使用的一种玻璃杯震落到地上一般不会被打碎,公交车的窗玻璃一旦打破即变成无尖锐棱角的小碎片,不会伤人,这种玻璃是
(A)普通钠玻璃 (B)石英玻璃 (C)光学玻璃 (D)钢化玻璃
10.将金属钠投入盛有酚酞稀溶液的小烧杯中,观察到下列现象,其中可说明钠和水的反应是放热反应的现象是
(A)金属钠浮在水面上 (B)金属钠成小球状
(C)金属钠在水面上迅速游动 (D)反应后的溶液呈现红色
11.碳酸钠和碳酸氢钠都是碳酸的钠盐,因而它们的性质有许多相似的地方,但也存在差异,以下关于两者性质的比较正确的是
(A)两者均可溶于水,但在相同条件下,碳酸氢钠比碳酸钠更易溶于水
(B)两者均可和稀盐酸反应,产生二氧化碳,但碳酸氢钠和盐酸反应剧烈得多
(C)用酒精灯加热时,两者均可发生分解反应,但碳酸氢钠更易分解
(D)两者均可和澄清石灰水发生化学反应,但碳酸氢钠在反应时不产生沉淀
12.某碱金属元素A(此处用A代替其元素符号),其原子半径比钠原子半径大,则下列关于A的推论不正确的有
(A) A原子的最外电子层上只有1个电子
(B) A单质和水反应比钠和水反应剧烈
(C) A的氢氧化物的碱性比NaOH碱性强
(D) A的单质和氧气反应比钠和氧气反应剧烈,且反应产物一定是A2O
13.阿伏加德罗常数(NA)最新测定数据为6.022 136 7×1023 mol-1,关于NA的较为准确的表述为
(A)0.012 kg 12C中所含的碳原子数就是NA
(B)1mol的任何粒子的粒子数就是NA
(C)6.022 136 7×1023就是NA
(D)12g任何碳原子中所含的原子数目就是NA
14.在标准状况下,1mol的任何气体所占的体积都约为22.4L,其主要原因是
(A)气体分子间的距离较大,且在标准状况下气体分子间平均距离几乎相等
(B)不同气体的分子大小几乎相等
(C)标准状况下不同气体的密度几乎相等
(D)标准状况下不同质量的气体其分子数几乎相等
15.实验室配制一定物质的量浓度的溶液时,需用到容量瓶,容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中转移液体时,需一定的耐心和技巧,有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是
(A)可以按此建议改进,因为可在使用容量瓶时带来方便
(B)不能按此建议改进,因为会降低容量瓶的精度
(C)如果加粗瓶颈,可将原刻在容量瓶瓶颈上的刻度改刻在容量瓶的瓶身上
(D)不必加粗瓶颈,因为向容量瓶中转移液体时,少量液体倒出瓶外,不会对溶液的浓度产生影响
16.一般含氧酸均有相应的酸酐,如SO2是H2SO3的酸酐,SO3是H2SO4的酸酐,那么次氯酸的酸酐应是
(A)Cl2 (B)Cl2O7 (C)Cl2O (D)HCl
17.常温下不和硅单质发生化学反应的物质是
(A)浓硫酸 (B)氢氟酸 (C)氢氧化钠溶液 (D)单质氟
18.有人提议元素周期表(指课本后所附的元素周期表)不再按不同的纵行分成主族、副族、零族、VIII族,而直接按各元素所在的列编号,如第1列、第2列、第3列…………,如果按此种编号方法,碳族元素应位于
(A)第4列 (B)第11列 (C)第14列 (C)第16列
19.X是VI A族元素,以下一些该元素组成的粒子的化学式中的n值不一定为2的是
![]() (A)阴离子:
(B)氧化物:XOn (C)气态氢化物:HnX (D)含氧酸HnXO4
(A)阴离子:
(B)氧化物:XOn (C)气态氢化物:HnX (D)含氧酸HnXO4
20.下列关于化学反应的现象或产物描述错误的是
(A)铁在氧气中燃烧产生黑色的Fe3O4
(B)铁粉和硫粉混合后点燃生成黑色的Fe2S3
(C)铜丝在氯气中燃烧生成棕色的烟(CuCl2小颗粒)
(D)铜片在氧气中加热,生成黑色的CuO
二、简答题(本大题共5小题,共32分)
21.(12分)用化学用语回答下列问题
(1)画出磷原子的原子结构示意图: ▲ 。
(2)写出H2S分子的电子式: ▲ 。
(3)用电子式表示氯化镁的形成过程: ▲ 。
(4)写出碳酸钡中加入稀盐酸的离子反应方程式 ▲ 。
(5)写出在加热条件下铜片和浓硫酸反应的化学方程式并标明该反应过程中电子转移的方向和数目。 ▲
22.(6分)将下列环境问题所对应的主要原因(A—F)填在相应的空格中(每格中只填一个字母)。
环境问题 产生原因
(1)酸雨 ▲ A、CO2浓度不断上升
(2)水土流失 ▲ B、大量使用塑料包装袋和塑料农用地膜
(3)温室效应 ▲ C、工业上大量排放SO2
(4)臭氧层被破坏 ▲ D、大量使用农药和化肥
(5)白色污染 ▲ E、乱砍滥伐森林
(6)土壤污染 ▲ F、大量使用氟利昂制品
23.(4分)浓硫酸可贮放在铁制的槽车内这是因为 ▲ ,人们发现该槽车上用于放出硫酸的铁管外口却腐蚀严重,这是为什么? ▲ 。
24.(6分)
(1)过氧化氢又称双氧水,它的分子结构可示意为H-O-O-H ,该分子中有 ▲ 个非极性键,经测定过氧化氢分子的极性比水分子的极性还要大,如果上式同时还表示分子中原子的空间排列方式的话,请评价该式所表示的过氧化氢分子结构是否合理,并简要说明作出判断的理由。 ▲ 。
(2)过氧化氢的水溶液呈弱酸性,如果将过氧化氢视为酸,则它被NaOH中和后所得的“盐”的化学式为 ▲ 。
(3)从氧化还原反应的角度看,过氧化氢如果被氧化,其氧化产物应是 ▲ ,如果实验室用向过氧化氢溶液中加入二氧化锰的方法来制取氧气,在该反应中过氧化氢是 ▲ (选填“氧化剂”、“还原剂”)。
25.(4分)“碳族元素的化合价主要有+4和+2,碳、硅、锗、锡的+4价的化合物是稳定的,而铅的+2价的化合物是稳定的。”这句话实际上指出了铅的+4价化合物是不稳定的,容易转变为+2价的化合物。这里所说的+4价的铅的化合物“不稳定”并不是指其热稳定性(即加热是否容易分解),而是指+4价的铅的化合物具有较强的 ▲ 性,如果向PbO2中加入浓盐酸,会产生黄绿色气体,写出该化学反应的化学方程式 ▲ 。
三、实验题(本大题共3小题,共13分)
26.(5分)为了确认电解质溶液中部分离子相互间能否发生反应,做了如下三组实验
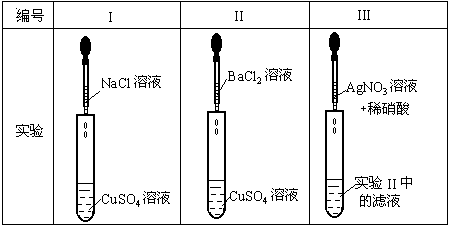
(1)实验I的目的是 ▲ 。
(2)实验II证明了 ▲ 离子和 ▲ 离子发生了化学反应,根据什么现象证明溶液中的另两种离子没有发生化学反应 ▲ 。
(3)实验III中反应的离子方程式为 ▲ 。
27.(2分)水通常是可用来灭火的,但在有时水却是引火的,如将少量水滴到包有超氧化钾(KO2)粉末的棉花上,棉花迅速发生剧烈的燃烧(比在空气中燃烧还剧烈),从这一事实可作出的推理有 ▲ 。(不要求写反应方程式)
28.(6分)某学生在研究性学习的课程中选定的课题是:测定能使带火星木条复燃的氧气体积分数的最小值。实验步骤如下:
① 取5-6只集气瓶,用量筒装水分别测定它们的容积并标记。
② 向集气瓶中分别装入其总容积的10%、20%、30%、40%、50%的水,并用毛玻璃盖住,依次编号为1、2、3、4、5。
③ 向大试管中加入1:10(质量比)的MnO2和KClO3的混合物,加热使其反应,分别用排水集气法将上述1-5号瓶中的水排去。
④ 将带火星的木条依次插入1-5号瓶中,观察并记录现象,列入下表:
| 集气瓶号 | 1 | 2 | 3 | 4 | 5 |
| 木条火星的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
请回答下列问题:
(1)用排水集气法收得氧气后,2号瓶中氧气的体积分数约为 ▲ 。
(2)如果要得到更精确的数据,下一步实验研究时应向第6只集气瓶中加入 ▲ % (取整数值)的水后,再用排水法收集氧气,然后用带火星的木条来试验。
(3)从已取得的实验数据分析,用“使带火星木条是否复燃”的方法来检验集气瓶中是否充满氧气的方法是否可靠? ▲ 。
四、计算题(本大题共2小题,共15分)
29.(8分)进行下列化学基本量的计算,将结果直接填入空格中
(1)147g H2SO4中所含的氧原子的物质的量为 ▲ mol。
(2)在标准状况下,100mL某气体的质量为0.179g,这种气体的相对分子质量为
▲ 。
(3)75mL 2 mol·L-1 NaOH溶液中NaOH的质量为 ▲ g。
(4)10 g 重水(D216O)中所含的中子为 ▲ 个。
30.(7分)硫酸和盐酸组成的混合液100.0 mL,向其中加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。(设溶液总体积始终不变)请列式计算
(1)原溶液中硫酸的物质的量。
(2)原混合液中盐酸的物质的量浓度。
高一年级教学质量检测
化学试题答题卷
| 题 序 | 一 | 二 | 三 | 四 | 总 分 |
| 得 分 |
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | ||||||||||
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 |
 |
二、简答题(本大题共5小题,共32分)
21.(6分)
(1) (2)
(3)
(4)
(5)
22.(6分)
(1) (2) (3) (4) (5) (6)
23.(4分)
; 。
24.(6分)
(1) ; 。
(2) 。 (3) ; 。
25.(4分)
; 。
 |
三、实验题(本大题共3小题,共13分)
26.(5分)
(1) ;
(2) ; ; 。
(3) 。
27.(2分)
28.(6分)
(1) (2) (3)
 |
四、计算题(本大题共2小题,共15分)
29.(8分)
(1) ; (2) ;(3) ;(4)
30.(7分)
(1)
(2)
高一年级教学质量检测
化学试题参考答案及评分标准
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | B | D | D | D | C | B | B | C | D | B |
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 | B | D | B | A | B | C | A | C | B | B |
二、简答题(本大题共5小题,共32分)
21.(12分)
![]()
![]() (1)
(2分) (2)
(2分)
(1)
(2分) (2)
(2分)
(3) (2分)
(4)BaCO3+2H+==Ba2++CO2↑+H2O (2分)
![]()
(5)Cu+2H2SO4(浓)========CuSO4+SO2↑+2H2O
(化学方程式2分,电子转移的方向和数目2分)
22.(6分)
(1)C (2)E (3)A (4)F (5)B (6)D 每空各1分
23.(4分)常温下浓硫酸可使铁发生钝化(2分);残留在管口的浓硫酸吸收空气中水分后逐渐变稀,稀硫酸能和铁发生化学反应(2分)
24.(6分)(1)1(1分);不合理,四个原子不可能同一条直线上(2分)
(2)Na2O2 (1分) (3)O2(1分);氧化剂、还原剂(全对1分)
25.(4分)
氧化性;(2分) PbO2+4HCl===PbCl2+Cl2↑+2H2O (2分)
三、实验题(本大题共3小题,共13分)
26.(5分)
(1)证明溶液中的Na+和SO42-、Cl-和Cu2+相互间不发生反应(或只答出Cu2+不发生化学反应)
(2)Ba2+;SO42-;反应后的液体过滤后得到的溶液呈蓝色。
(3)Ag++Cl-===AgCl↓
(每个空格各1分)
27(2分)KO2可和水发生化学反应,该反应是放热反应,该反应的产物中有O2。
28(6分)
1. 36.8%(数据在36%~37%之间均可) (2分)
2. 35 (数据在31~39之间均可) (2分)
3. 不可靠 (2分)
四、计算题(本大题共2小题,共15分)
29.(8分)(1)6 (2)40 (3)6 (4)5NA(或3.01×1024) 每空2分
![]() 30.(1)
30.(1)
溶液已呈碱性,Ba(OH)2过量 (1分)
Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
1 1
x 2.33 g/233 g·mol-1
解得x=0.0100 mol (2分)
(2)
剩余n (OH-):0.100 mol·L-1×0.100 L = 0.0100 mol (1分)
n(HCl)=(0.0250 mol -0.0100 mol - 0.0100 mol /2)×2 = 0.0200 mol (2分)
c(HCl) ==0.0200mol/0.100L== 0.2mol·L-1 (1分)
答:略。