高一年级阶段考试化学试卷
本试卷可能用到的相对原子质量
C=12,H=1,O=16,Mg=24,S=32,Na=23,Ba=137,Cl=35.5
一.选择题(每小题只有一个选项符合题意)
1.下列各组反应,前者是氧化还原反应,后者是非氧化还原反应的是
A.实验室制取氧气;实验室制取氢气
B.生石灰CaO溶于水;二氧化碳通入石灰水中
C.实验室制取氢气;实验室制取二氧化碳
D.氢、氧混合气体爆鸣;液化石油气燃烧
2.从反应类型的角度来看,下列化学反应中,与另外三个反应不相同的是
A.锌粒与稀硫酸作用产生氢气
B.铁粉投入硫酸铜溶液析出单质铜
C.镁条在二氧化碳气体中燃烧生成氧化镁和单质碳
D.一氧化碳还原三氧化二铁得单质铁和二氧化碳
3.下列各种物质导电性最差的是
A.稀硫酸 B.澄清的石灰水 C.铁丝 D.固体食盐
4.下列叙述正确的是
A.强电解质都是离子化合物,因此NaCl是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3是电解质
D.硫磺是单质,不导电,因此硫磺是非电解质
5.下列说法正确的是
A.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质
B.氧化剂在反应中被氧化,还原剂在反应中被还原
C.阳离子只有氧化性,阴离子只有还原性
D.盐酸既有氧化性,又有还原性
二.选择题(每小题有一至两个选项符合题意)
6.向某Ba(OH)2溶液中逐滴滴入一定密度的稀H2SO4,则溶液的导电能力,下列叙述,描述正确的是
A.开始时,导电能力肯定最强 B.当沉淀为最大值时,导电性最弱
C.先变强,后变弱 D.逐渐变弱
7.下列说法正确的是
A.醋酸溶液的导电能力一定不如盐酸强
B.硫酸溶液在通直流电条件下发生电离
C.铁是单质,它不是电解质,也不是非电解质
D.碳酸氢铵溶液既可与盐酸反应又能与氢氧化钠溶液反应
8.下列变化过程是吸热的有
A.生石灰溶于水变成熟石灰 B.干冰用于舞台布景产生雾
C.稀硫酸与氢氧化钠溶液发生中和 D.CaCO3分解
9.下列各组溶液之间的反应,所用离子方程式表示相同的是
A.硝酸钡与稀硫酸,氯化钡与硫酸钠
B.盐酸与碳酸钠,盐酸与碳酸氢钠
C.氢氧化钠与硫酸,氢氧化钡与硫酸
D.氢氧化钠与盐酸,氢氧化钾与醋酸
10.黑火药的爆炸反应方程式可表示为:2KNO3+S+3C====K2S+N2+3CO2
其中氧化剂是
A.只有C B.只有KNO3 C.KNO3和S D.只有S
11.已知下列三个离子反应方程式如下:
①X2++Y===X+Y2+;②Y2++W===W2++Y;③W2++Z===Z2++W,
则氧化性最强的粒子是
A.X2+ B.Y2+ C.W2+ D.Z2+
12.在强酸溶液中,下列各组离子能大量共存的是
A.Na+、Ba2+、NO3-、Cl- B.Na+、Cl-、NO3-、Ag+
C.NH4+、Na+、SO42-、K+ D.Na+、HCO3-、K+、Cl-
13.下列化学反应中,离子方程式表示正确的是
A.碳酸钙溶解在稀盐酸中 CO32-+2H+===CO2↑+H2O
B.铁屑与稀硫酸作用产生氢气 2Fe+6H+===2Fe3++3H2↑
C.NaHCO3溶液与NaOH溶液恰好完全反应 H++OH-===H2O
D.往Ba(OH)2溶液中逐滴滴入稀硫酸至恰好呈中性
Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O
14.下列反应可用离子方程式H++OH-===H2O表示的是
A.往稀硫酸溶注中滴加氢氧化钡溶液
B.往稀氨水中逐滴滴入稀盐酸
C.往碳酸氢钠溶液中滴加氢氧化钠溶液
D.往硫酸氢钾溶液中滴加氢氧化钾溶液
15.经测定由C3H8O和C6H12组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数是
A.78% B.22% C.14% D.13%
16.氯化氢的水溶液能够导电,其确切的解释理由是
A.在外加电流的作用下HCl电离出H+和Cl-
B.在液态氯化氢中存在大量自由移动的离子
C.HCl分子在水分子作用下电离出自由移动的H+和Cl-
D.HCl分子本身也能够导电
17.人类将在二十一世纪大量使用氢气作燃料,其中最理想的获取氢气的途径是
A.以焦炭和水制取水煤气后分离出氢气
B.用铁、锌等活泼金属与稀硫酸制取氢气
C.由火力发电厂提供电力电解水产生氢气
D.利用高效催化剂和太阳能使海水分解产生氢气
18.下列反应一定不是离子反应的是
A.实验室用二氧化锰与氯酸钾共热制取氧气
B.工业上以石灰石煅烧制取生石灰
C.实验室用锌料与稀硫酸制取氢气
D.实验室用石灰石(主要成分CaCO3)与稀盐酸制取二氧化碳气体
19.某温度下,向硫酸镁饱和溶液(此时溶液的溶质质量分数为25%)中加入1g无水MgSO4可析出3.15g MgSO4·nH2O晶体,则n为
A.3 B.5 C.7 D.10
20.t℃时,将某烧碱溶液蒸发掉8.2g水后,析出5.8g NaOH·H2O晶体;再蒸发掉1.2g水后,恢复到t℃又析出5.8g NaOH·H2O晶体,则t℃时,饱和烧碱溶液中溶质质量分数为
A.41.43% B.57.14% C.82.86% D.无法确定
|
21.根据化学反应:Cu+2H2SO4(浓) ====CuSO4+SO2↑+2H2O,试回答以下问题。(已知Cu的相对原子质量64)
⑴该反应中氧化剂是_______________,被氧化的元素是_____________;
⑵当有32g Cu溶解时,被还原的H2SO4的质量为___________g。
22.写出符合下列要求的化学反应方程式,各任写一个。
⑴一种阳离子氧化一种单质_______________
⑵一种单质氧化一种化合物________________
⑶同一种物质中不同元素之间发生氧化还原反应______________
23.已知硫酸铅是一种作画的白色颜料,难溶于水,也难溶于稀硝酸,但该物质却可以溶于醋酸铵溶液形成无色溶液,其化学方程式可表示为:
PbSO4+2CH3COONH4===Pb(CH3COO)2+(NH4)2SO4
根据离子反应发生的条件,以上反应中,____________为弱电解质(写化学式)。
假如往上述含有Pb(CH3COO)2的溶液中通入H2S气体,则溶液中立即出现黑色沉淀PbS,其化学方程式可表示为:Pb(CH3COO)2+H2S===PbS↓+CH3COOH
请依据上述反应事实,写出以上两个反应的离子方程式_____________、___________。
四.实验题
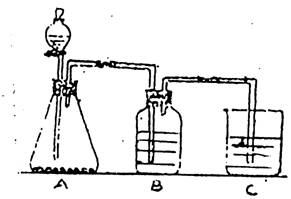 24.为了确认CH3COOH>H2CO3>H2SiO3的酸性强弱顺序,有人设计了如右下图所示装置,一次实验达到目的(注:H2SiO3不溶于水;不能再选用其它酸性溶液)
24.为了确认CH3COOH>H2CO3>H2SiO3的酸性强弱顺序,有人设计了如右下图所示装置,一次实验达到目的(注:H2SiO3不溶于水;不能再选用其它酸性溶液)
⑴锥形瓶装某可溶性正盐固体,分液漏斗中所盛试剂是_______________。
⑵装置B中所盛试剂是____________________________。其作用是____________________
____________________________。
⑶装置C中出现的现象是_______________________________。
⑷写出相关反应的离子方程式:
五.计算题
25.向某BaCl2溶液中逐滴加入某硫酸溶液,使其恰好完全反应,过滤,测得滤液的质量与原BaCl2溶液的质量相等。求该硫酸溶液中溶质的质量分数。
高一化学参考答案
一、二、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | D | D | B | D | B | CD | BD | A | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | AC | D | D | C | C | D | AB | C | B |
三、21.⑴H2SO4, Cu ⑵49g
|
|
|
23.P0(CH3COO)2;PbSO4+2CH3COO-=Pb(CH3COO)2;
Pb(CH3COO)2+H2S=PbS↓+2CH3COOH
四、24.⑴CH3COOH;
⑵饱和NaHCO3溶液;其作用:除去(吸收)挥发出的醋酸
⑶产生(白色)沉淀;
⑷2CH3COOH+CO32—=2CH3COO—+CO2↑+H2O
CH3COOH+HCO3—=CH3COO—+H2O+CO2↑
(CO2+H2O+SiO32—=CO32—+H2SiO3↓)
五、计算题
25.解:根据题意:![]() ,
,
又因:![]()
∴![]()