高一化学第一学期期末考试试题
化 学
可能用到的相对原子质量:H:1, O:16, C:12, Na:23, K:39
Rb:85 Cl:35.5,S:32,Mn:55,Ag:108
说明: 1.请将答案填在答案卡上,只交答案卡;
2. 本卷满分100分,时间90分钟。
一、选择题(每小题只有一个选项符合题意,每题2分,共10分)
1、 碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一问题,我国已经
开始实施“智力工程”,最经济可行的措施是
A、大量食用海带 B、食用加碘盐 C、面包加碘盐 D、 注射含碘药剂
2、物质的量相同的任何气体物质,相同的是
A、体积 B、质量 C、摩尔质量 D、分子数
3、将溴水与下列各种溶液混合并振荡,静置后混合液分层,使溴水层变成无色的液体是
A、氯水 B、苯 C、碘化钾溶液 D、氯化钠溶液
4、等质量的①CH4,②H2,③HCl,④SO2,在标准状况下所占体积由大到小排列的顺序是
A、②>①>③>④ B、④>③>①>②.
C、③>②>④>① D、①>④>②>③
5、下列说法正确的是
A、摩尔是七个基本物理量之一 B、阿伏加德罗常数是没有单位的
C、氧气的摩尔质量是32 g D、1mol H2O约含有6.02×1023个水分子
二、选择题(每小题只有一个选项符合题意,每题3分,共45分)
6、如右图,A处通入Cl2,关闭B阀时, C处的红布看
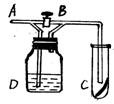 不到明显现象;当打开B阀后,C处的红布条逐渐褪色。
不到明显现象;当打开B阀后,C处的红布条逐渐褪色。
则D瓶中装的是
A、浓H2SO4 B、HCl溶液
C、 H2O D、饱和NaCl溶液
7、用物质的量浓度为Amol/L,体积为VmL的AgNO3溶液分别与100mLNaCl、MgCl2、AlCl3溶液反应完全,则这三种溶液的物质的量浓度之比为
A、1:2:3 B、2:3:6 C、6:3:2 D、2:6:3
8、当金属铷和另一碱金属等物质的量组成的合金4.6g跟水完全反应时,产生氢气在标准状况下为2.24 L,则合金中的另一种金属可能是
A、Na B、Li C、K D、Cs
9、在同温同压下,10L N2和CO2的混合气体通过足量的Na2O2后,测得气体的体积是6L,原混合气中,CO2的体积分数是
A、20% B、40% C、60% D、80%
10、下列说法正确的是
A、碘化氢的还原性比溴化氢的还原性强
B、卤素单质(X2)与水反应的通式为:X2+H2O=HX+HXO
C、卤化氢的酸性从氢氟酸到氢碘酸酸性逐渐减弱
D、卤化银都是难溶于水的白色沉淀
11、有甲、乙、丙三种溶液,各含有X-(Cl-,Br-,I-)离子,向甲中加入淀粉溶液和氯水,溶液变为橙色,再加入丙,颜色无明显变化,则甲、乙、丙依次含有
A、 Br-,Cl-,I- B、Br-,I-,Cl- C、 I-,Br-,Cl- D、Cl-,I-,Br-
12、在反应8NH3+3Cl2=6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比
A、3:1 B、 1:3 C、 1:1 D、3:8
13、根据下列化学方程式:2FeCl3+2KI=2FeCl2+2KCl+I2, 2FeCl2+Cl2=2FeCl3,
2KMnO4+16HCl=2MnCl2+5Cl2↑+8H2O,判断各物质氧化性由大到小的顺序正确的是
A、I2>Cl2>FeCl3>KMnO4 B、KMnO4 >Cl2>FeCl3>I2
C、Cl2>I2>FeCl3>KMnO4 D、FeCl3>KMnO4>Cl2>I2
14、氯仿(CHCl3)可用做全身麻醉剂,但在光照下,易被氧化生成剧毒光 气(COCl2):2CHCl3+O2→2HCl+2COCl2,为了防止发生事故,在使用 前要先检验是否变质,你认为检验时所用的最佳试剂是
A、烧碱溶液 B、溴水 C、硝酸银溶液 D、淀粉碘化钾试纸
15、 设NA 为阿伏伽德罗常数, 下列说法正确的是
A、常温常压下, 0.1NA个H2S分子的质量为3.4g
B、标况下, 22.4L 氖气含有2NA 个原子
C、7.1g Cl2 变为氯离子时, 得到的电子数为0.1NA
D、1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA
16、将标准状况下的a L氯化氢气体溶于100g水中,得到的盐酸的密度为bg/mL,则该盐酸的物质的量的浓度是
A、![]() B、
B、![]()
C、![]() D、
D、![]()
17、下列各组离子能在强酸性溶液中大量共存的是
A、Na+、K+、I-、 HCO3- B、Ca2+、NH4+、Br--、S2-
C、K+、Cu2+、Cl-、SO42- D、Mg2+、Ca2+、Cl-、CO32-
18、3.9g钾投入到18g水中,反应后溶液中钾离子与水分子的物质的量之比为
A、39:18 B、1:10 C、1:9 D、1:90
19、有五瓶溶液分别是①10mL 0.60mol/L NaOH水溶液 ②20mL 0.50mol/LH2SO4水溶液③30mL0.40mol/L HCl溶液 ④40mL0.30mol/LCH3COOH水溶液 ⑤50mL0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
A、①>②>③>④>⑤ B、②>①>③>④>⑤
C、②>③>④>①>⑤ D、⑤>④>③>②>①
20、24mL浓度为0.05mol/L的NaSO3溶液,恰好与20mL浓度为0.02mol/L的K2Cr2O7 溶液完全反应,则元素Cr 在被还原的产物中的化合价是
A、+6 B、+3 C、+2 D、0
三、填空题(共17分)
21、(5分) 17g NH3共有 mol电子,0.1molH2S共有约 个电子,同温同压下,同体积的NH3和H2S气体的质量比为 ;同温同压下,同质量的NH3和H2S气体的体积比为 ;同质量的NH3和H2S中氢原子的个数比为 。
22、(4分)Na2CO3固体中混有少量NaHCO3,除去的方法是 ,反应的化学方程式是 ;NaOH溶液中少量Na2CO3,
除去的方法是 ,反应的离子方程式是
。
23、(2分)21. 3 gCl2与9.6g某单质R x 所含原子数目相同,且分子数之比为3∶2, 则R的相对原子质量是 ,x值是 。
24、(6分) 称取一定量的纯碱,溶于水加入足量盐酸,充分反应后产生一定体积的CO2以下用“增多”或“减少”来填空。
(1)若纯碱含少量NaHCO3,则所需盐酸用量 ;产生的CO2体积 。
(2)若纯碱含少量NaOH,则所需盐酸用量 ;产生的CO2体积 。
(3)若纯碱含少量K2CO3,则所需盐酸用量 ;产生的CO2体积 。
四、实验题(共20分)
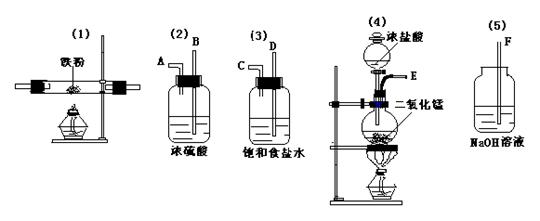
![]() 25、(13分)实验室中用下列仪器和药品来制取纯净的无水FeCl3,图中的A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出。
25、(13分)实验室中用下列仪器和药品来制取纯净的无水FeCl3,图中的A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出。
① 如果所制气体从左到右流向,上述各仪器装置正确连接顺序是(填序号)
( )接( )接( )接( )接( ); 其中 ⑵与⑶装置相连时,玻璃管口应是
接 (填字母)
②装置⑵的作用是 ;装置⑶的作用 ;装置⑸发生反应的离子方程式 。
③实验开始时,应首先检验装置 ;实验结束应先熄灭 处的酒精灯。
④装置⑷发生的化学方程式为 。
⑤写出装置⑴中发生的化学方程式 。
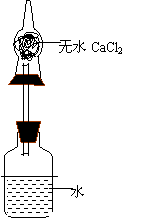 26、(7分)为了测定某碱金属的相对原子质量,设计的实验装置如右图,整个装置、药品(包括广口瓶中的水,干燥管内的干燥剂无水CaCI2)的总质量为480.00g ,将质量为1.38g某碱金属投入水中,立即塞紧瓶塞,反应完毕后整个装置、溶液的总质量为481.32g。试回答下列问题:
26、(7分)为了测定某碱金属的相对原子质量,设计的实验装置如右图,整个装置、药品(包括广口瓶中的水,干燥管内的干燥剂无水CaCI2)的总质量为480.00g ,将质量为1.38g某碱金属投入水中,立即塞紧瓶塞,反应完毕后整个装置、溶液的总质量为481.32g。试回答下列问题:
![]()
![]() (1)该金属的相对原子质量是
,元素符号是
;
(1)该金属的相对原子质量是
,元素符号是
;
(2)装置中干燥管的作用是 。
(3)若没有干燥管,则测得的该金属的相对原子质量的结果,将比实际 。(填偏大、偏小或不影响)
五、计算题(8分)
.27、实验可用高锰酸钾与浓盐酸反应制氯气,该反应的化学方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O 。①将7.9 g高锰酸钾与50 mL12 mol/L盐酸反应可制得多少升氯气(标准状况)?②若往反应后的溶液中加入足量的硝酸银溶液,可生成多少克氯化银沉淀?
高一第一学期化学期末考试答卷卡
一、二、选择题(共55分)

| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | D | B | A | D | A | C | B | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | B | C | A | D | C | C | D | B |
三、填空题(共17分)
21、(5分) 10 、 1.08×1024 、 1:2 、 2:1 、 3:1 。
22、(4分) 加热固体至不再有气体产生为止,NaCO3=NaCO3+H2O+CO2↑;
加入适量Ba(OH)2或Ca(OH)2过滤,Ca2++CO32-=CaCO3
23、(2分) 16 、 3 。
24、(6分) (1) 减少 、 增多 ;
(2) 增多 、 减少 ;
(3) 减少 、 减少 。
四、实验题(共20分)
25、(13分)
(1) ( 4 )接( 3 )接( 2 )接( 1 )接( 5 ); C 接 B
(2) 干燥Cl2 、 除杂(HCl) 。
Cl2+2OH-=Cl-+ ClO-+H2O
(3) 气密性 、 (1) 。
加热
(4) MnO2+4HCl(浓)=====MnCl2+ Cl2+↑+2 H2O
(5) 加热
3Fe+2Cl2===== FeCl3
26、(7分)(1) 23 、 Na 。
(2) 吸收H2带走的水分 。
(3) 偏小 。
五、计算题(8分)
解: △
(1) 2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
2mol 16 mol 5mol
7.9/158=0.05mol 12×0.05=0.6mol x=0.125mol
所以HCl过量,以KMnO4的量来计算
V(Cl2)=o.125mol×22.4L=2.8L
(2) 根据氯元素守恒: Cl-————AgCl
1mol 143.5g
0.6-0.125×2=0.35mol y=50.1g