高一化学第一学期期末试题
(时间120分钟 满分100分)
可能用到的相对原子质量:H-1、C-12、N-14、O-16、Na-23、S-32、C1-35.5、K-39、I-127
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。)
1.下列物质中,分子数最多的是
A. 11.2升氢气(标准状况) B.16克液态氧
C. 6.02×1023个一氧化碳分子 D.2摩蔗糖
2.含有氯离子的物质是
A.氯水 B.液氯 C.氯酸钾溶液 D.氯气
3.在反应 2F2十2H20====4HF十O2 中,水是
A.还原剂 B.氧化剂 C.催化剂 D.脱氧剂
4.遇C12不会有颜色变化的是
A.湿润的蓝色石蕊试纸 B.湿润的淀粉碘化钾试纸
C湿润的红色布条 D.干燥的红色布条
5.下列物质属于电解质的是
A.石墨 B.蔗糖
C.Cu D.NaC1
6.下列变化加入氧化剂能发生的
![]()
![]() A.Cu2+ Cu
B.C1— C12
A.Cu2+ Cu
B.C1— C12
![]()
![]() C.H2SO4 SO2
D.CO2 CO32—
C.H2SO4 SO2
D.CO2 CO32—
7.同温同压下,等质量的下列气体所占体积最大的
A.HCl B.H2S
C.NH3 D.O2
8.标准状况下,1.6L N2含有m个分子,则阿伏加德罗常数为
A.14m B.28m C.m/28 D.7m
9.氯化碘(IC1)的化学性质跟氯相似,预计它跟水反应最初生成物为
A.HI 和 HClO B.HCl和HIO C.HClO3和HI D、HClO和HIO
10.VLAl2(SO4)3溶液含Al3+ng,则溶液中SO42—的物质的量浓度是
![]()
![]()
![]()
![]()
11.设NA表示阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6L氧气含有n个O2,则NA为4n
B.常温常压下,1mol氦气含有的原子数为2NA
C.常温下,1mol氯气与足量的烧碱反应,转移的电子数为2 NA
D.18克水中所含的电子数为8 NA
12.某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低。该学生找出以下原因,其中不会使溶液浓度偏低的是:
A.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
B.容量瓶刚用蒸馏水洗净,没有烘干
C.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
D.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
13.两个体积相同的容器,一个盛有一氧化碳,另一个盛有氧气、氢气、氮气的混合气体。在同温同压下,两容器内的气体一定具有相同的是
A.原子总数 B.电子总数 C.质子总数 D.质量
14.下列物质不是化石能源的是
A.煤 B.酒精 C.石油 D.天然气
15.下列离子方程式正确的
A.碳酸氢钙溶液跟稀硝酸反应:HCO3—+ H+ == CO2↑ + H2O
B.澄清石灰水跟稀硝酸反应:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C.金属钠投入水中:Na 十 H2O = Na+ 十 2OH— 十 H2↑
D.碳酸钙溶于醋酸:CaCO3 + 2H+ == Ca2+ + CO2↑十H2O
16.在x R2+ +y H+ +O2 = m R3+ +n H2O 的离子反应中,系数m的数值为
A.2x B.4 C.y /2 D.2
17.将一块表面已被氧化生成Na2O的金属Na,其质量为10. 8g,将其投入100g水中,放出H 2 0.2 g。则被氧化的钠的质量是
A.4.6g B.6.2g C.7.8g D.9.2g
18.在自然界中存在游离态的元素是
A.Cl B.Na C.O D.Br
19.钠与水反应时的现象与钠的下列性质无关的是
A.钠的熔点低 B.钠的密度小 C.钠的硬度小 D.有强还原性
20.一块金属钠,长期放在空气中,最终生成
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
21.下列物质导电能力最差的是
A.固体钠 B.NaOH固体 C.盐酸 D.KNO3溶液
22. 23g钠溶于77g水中,所得溶液的溶质质量分数为
A.等于23% B.等于40% C.小于40% D.大于40%
23.水的相对分子质量为18,则一个水分子的质量为

24.有15g A物质与10.5g B物质恰好完全反应,生成7.2gC物质、1.8g D物质和0.3mol E物质。则E物质的摩尔质量是
A.27.5g B.55g/mol C.100mol D.111g/mol
25.在反应8NH3+3Cl2 = 6NH4Cl+N2中,被氧化的氨与未被氧化的氨的物质的量之比为
A.8∶3 B.6∶1 C.3∶1 D.1∶3
答题卷
| 题号 | 一 | 二 | 三 | 四 | 五 |
| 得分 |
|
|
|
|
|
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。请将答案填入下表!)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
|
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题(共22分)
26.(6分)向盛有硫酸铜和硫酸镁混合液的试管中投入一小块钠,反应结束后,可能沉于试管底部的固体物质是 ,该反应的化学方程式是:
。
27.(6分)向100ml、0.01mol/L的NaOH溶液中加入 g NaOH固体后,溶液中OH-离子浓度为0.1mol/L(不考虑溶液体积的变化),再吸收标准状况下 mL HCl气体后NaOH恰好完全转化为NaCl,发生的化学反应可用离子方程式表示为: 。
28.(10分)(1)写出实验室用MnO2和浓盐酸反应的方程式,并注明必要的条件:
;
(2)KMnO4在酸性溶液中氧化性很强的,是常用的氧化剂,MnO4-通常被还原成Mn2+,写出KMnO4和浓盐酸在常温下反应的方程式:
;
(3)历史上曾用“地康法”制氯气。这一方法是用浓盐酸在催化剂(CuCl2)和450℃的条件下,与空气中的氧气反应制氯气。这一反应的化学方程式为:
;
(4)从氯元素化合价的变化看,以上三种方法的共同点是 ;
(5)比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序为 。
三、推断题(7分)
29(2分).常温下,X和Y两种气体组成混和气体(X的相对分子质量小于Y),经分析混和气体中只含有氢、氯两种元素,而且不论X和Y以何种比例混和,氢与氯的质量比总大于2:71,请确定X是 ,Y是 (用分子式表示)
30(5分).有A、B两种钠盐,各取适量混合,加入少量水后再强热生成气体C和残留固体D,C极易溶于水生成无色溶液E,将D或B溶于水后加入硝酸钡,生成不溶于稀硝酸的白色沉淀,E的浓溶液与二氧化锰共热生成黄绿色气体F。A溶于水显酸性。推断各物质的化学式:
A 、B 、C 、D 、F 。
四、实验题(共12分)
31(3分)配制浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是 (填代号)。
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
32(9分)、设计实验来证明氯酸钾中含有钾、氯、氧三种元素(不一定要填满表中的步骤)
| 实验步骤 | 实验现象 | 结论、解释、反应方程式 |
| 1、 | ||
| 2、 | ||
| 3、 | ||
|
|
五、计算题(共9分)
33(5分).将15.6g Na2O2完全溶于适量的水中将产生(标准状况)氧气体积?再将所得溶液加水稀释为500mL,推算该500mL溶液物质的量浓度。
34(4分).标况下,一个装满Cl2的容器为74.6g,若装满N2,则质量为66g,则此容器的容积为多少升?
参考答案及评分标准
一、选择题(本题包括25小题,每小题只有一个选项符合题意,每小题2分,共50分。请将答案填入下表!)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | D | A | A | D | D | B | C | A | B | B | A | B |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
A | B | A | B | A | C | C | D | B | D | D | B | D |
二、填空题(共22分)
26(6分)Cu(OH)2、Mg(OH)2
‚2Na + CuSO4 + 2H2O === Cu(OH)2¯ + Na2SO4 + H2或…
ƒ2Na + MgSO4 + 2H2O === Mg(OH)2¯ + Na2SO4 + H2或…
27(6分). 0.36g 224 H+ + OH— = H2O
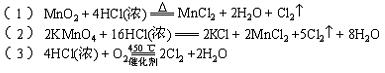 28(10分)
28(10分)
(4)氧化剂将浓盐酸中氯元素氧化成氯气
(5)KMnO4>MnO2>O2 (以上三个反应的条件并不相同,反应条件越低,说明反应越易进行,则体现氧化剂的氧化性越强,反之,氧化剂的氧化性越弱。)
三、推断题(7分)
29(2分).H2 HCl
30(5分). NaCl NaHSO4 HCl Na2SO4 Cl2
四、实验题(共12分)
31.
| 实验步骤 | 实验现象 | 结论、解释、反应方程式 |
| 1.强热试管中的氯酸钾 | 产生能使余烬复燃的无色气体 | 说明氯酸钾中含有氧元素 2KClO3 |
| 2.待试管冷却后往其中滴入硝酸银溶液 | 产生不溶于稀硝酸的白色沉淀 | 说明氯酸钾中含有氯元素 Ag+ + Cl- = AgCl¯ |
| 3.用氯酸钾做焰色反应实验 | (透过蓝色钴玻璃片观察)焰色呈紫色 | 说明氯酸钾中含有钾元素 |
|
|
五、计算题(共9分)
33.(5分) 2.24L 0.8mol/L
34.(4分) 74.6g – 66g = V ÷ 22.4L/mol × 71g/mol - V ÷ 22.4L/mol × 28g/mol
V = 4.48L